
科目: 来源: 题型:选择题
| A. | 苯和溴水共热 | B. | 光照甲苯与氯气的混合物 | ||
| C. | 溴乙烷与NaOH溶液共热 | D. | 乙烷通入溴的四氯化碳溶液中 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 篮烷的分子式为C12H20 | |
| B. | 篮烷分子中存在2个六元环 | |
| C. | 篮烷分子中存在3个五元环 | |
| D. | 篮烷的一氯代物共有4种同分异构体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  | B. | 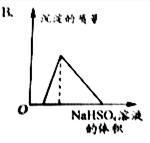 | ||
| C. |  | D. | 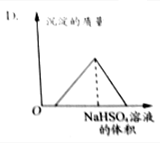 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2+H2O?H2SO3 | B. | SO2+2NaOH?Na2SO3+H20 | ||
| C. | 2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3 | D. | SO2+CaO═CaSO3 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| 操作 | 现象 | 结论解释 | |
| A | 过量铁粉加稀硝酸充分反应,滴入KSCN溶液 | 产生红色溶液 | 稀HNO3将铁氧化成Fe3+ |
| B | 某实验小组从资料上获得信息:Fe3+可以氧化银单质.他们用这种方法清洗一批作了银镜反应的试管,配制了Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别用于清洗实验. | 用FeCl3溶液清洗比Fe2(SO4)3溶液清洗得干净 | 他们认为Fe3+氧化银单质的过程可能是一个可逆过程:Fe3++Ag?Fe2++Ag+ |
| C | 苯酚钠溶液中通入少量CO2气体 | 溶液变浑浊 | 碳酸酸性强于苯酚,溶液中还有Na2CO3生成 |
| D | 相饱和碳酸钠溶液通过量CO2气体 | 产生沉淀 | 因为析出Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com