
科目: 来源: 题型:解答题
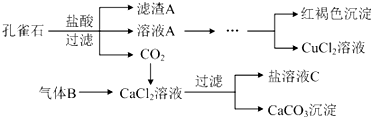
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | NaX的水溶液的碱性一定强于NaY水溶液的碱性 | |
| B. | HX一定是弱酸 | |
| C. | 反应结束时两者所用时间相同 | |
| D. | 浓度:C(HX)>C(HY) |
查看答案和解析>>
科目: 来源: 题型:解答题
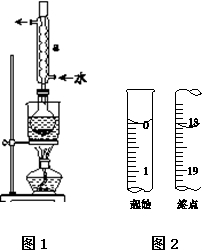 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
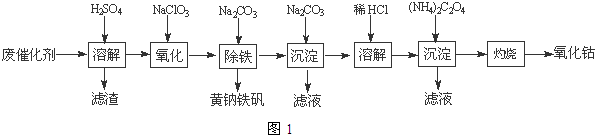
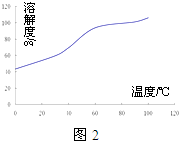 (4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2•3Co(OH)2],沉淀需洗涤,洗涤的操作是向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次.
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2•3Co(OH)2],沉淀需洗涤,洗涤的操作是向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石墨比金刚石稳定 | |
| B. | 等质量的石墨比金刚石能量高 | |
| C. | 发生了物理变化 | |
| D. | 金刚石转化为石墨没有化学键的断裂与生成 |
查看答案和解析>>
科目: 来源: 题型:填空题
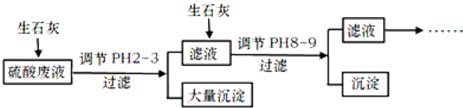
查看答案和解析>>
科目: 来源: 题型:解答题
| 试剂 温度 | T1/℃ | T2/℃ | T3/℃ |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
查看答案和解析>>
科目: 来源: 题型:解答题
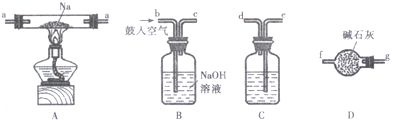
| 猜想 | 实验设计 | 现象与结论 |
| 剩余气体为H2(或O2). | 将b中剩余气体通过灼热的氧化铜 (或将b中剩余气体通过灼热的铜网). | 若看到黑色固体变红(或红色固体变黑), 证明此猜想正确,反之则不正确. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com