
科目: 来源: 题型:多选题
| 温度℃ | 400 | 500 | 830 | 1000 |
| 平均常数K | 10 | 9 | 1 | 0.6 |
| A. | 上述反应中正反应是吸热反应 | |
| B. | 该反应的化学平衡常数表达式为K=$\frac{\{c({H}_{2})•c(C{O}_{2})\}}{\{c(CO)•c({H}_{2}O)\}}$ | |
| C. | 该反应在400℃时达平衡状态,若升高温度,则正反应速率减小,逆反应速率增大 | |
| D. | 在830℃,2L的密闭容器中,冲入1molCO、5molH2O(g)、3molCO2和2molH2发生上述反应,在达到平衡前V(正)<V(逆) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 制取无水MgCl2,将MgCl2溶液直接蒸干 | |
| B. | 除去CuCl2溶液中含有的少量FeCl2,向溶液中加入过量CuO,待充分反应后过滤 | |
| C. | 的检验:取少量试样于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,则试样中含有 | |
| D. | 探究反应的限度:将1mL0.1mol•L-1的KI溶液与5mL0.1mol•L-1的FeCl2溶液混合,待充分反应后,滴加KSCN溶液,观察实验现象 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2、CH4、N2等均是造成温室效应的气体 | |
| B. | “地沟油”经过加工处理后,可以用来制造燃油 | |
| C. | 铁粉、生石灰、硅胶是食品包装中常用的干燥剂 | |
| D. | 目前加碘食盐主要添加的是KI |
查看答案和解析>>
科目: 来源: 题型:选择题
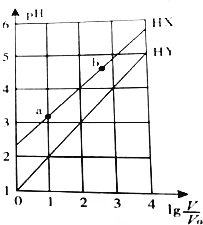
| A. | HX、HY都是弱酸,且HX的酸性比HY的弱 | |
| B. | 常温下,由水电离出的c(H+)•c(OH-):a<b | |
| C. | 相同温度下,电离常数K( HX):a>b | |
| D. | lg$\frac{V}{{V}_{0}}$=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则$\frac{c({X}^{-})}{c({Y}^{-})}$减小 |
查看答案和解析>>
科目: 来源: 题型:解答题
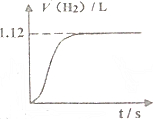 常温下在1LpH=3的HA溶液中加入过量铁粉,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)
常温下在1LpH=3的HA溶液中加入过量铁粉,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)查看答案和解析>>
科目: 来源: 题型:填空题
 实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配置情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配置情况回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0 | 28 | 35.7 | 4.7 | 163 |
| 40 | 40.1 | 36.4 | 26.3 | 215 | |
| 80 | 51.3 | 38 | 73 | 376 | |
查看答案和解析>>
科目: 来源: 题型:解答题

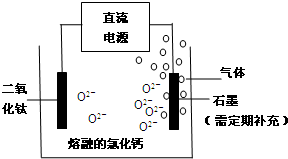
查看答案和解析>>
科目: 来源: 题型:填空题
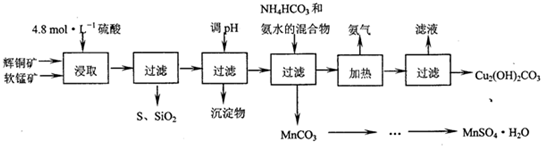
| 开始沉淀的PH | 沉淀完全的PH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
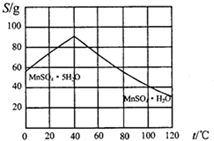
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com