
科目: 来源: 题型:选择题
| A. | 用溴水代替碘水进行萃取实验 | |
| B. | 用过量的氯气进行性质实验 | |
| C. | 用乙烯和氧气在银作催化剂的条件下制备环氧乙烷 | |
| D. | 用铜粉代替铜丝进行铜和浓硝酸反应的实验 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=12的溶液:NO3-、I-、Na+、Al3+ | |
| B. | 0.1mol•L-1 CH3COONa溶液:Mg2+、H+、Cl-、SO42+ | |
| C. | Kw/c(H+)=0.1mol•L-1 的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 0.1mol•L-1 KMnO4溶液:Na+、Mg2+、NO3-、SO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
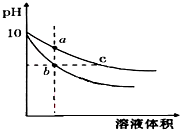 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH 随溶液体积变化的曲线如图所示,则下列叙述不正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH 随溶液体积变化的曲线如图所示,则下列叙述不正确的是( )| A. | b、c两点溶液的导电能力不相同 | |
| B. | a、b、c三点溶液中水的电离程度a>c>b | |
| C. | 用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vb=Vc | |
| D. | c点溶液中C(H+)+C(CH3COOH)=C(OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题
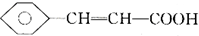 ),继而合成H的路线如下:
),继而合成H的路线如下:
 ,D中含有官能团的名称为羰基、醛基;
,D中含有官能团的名称为羰基、醛基;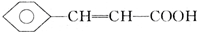 +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$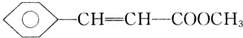 +H2O;
+H2O;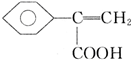 、
、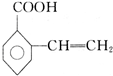 、
、 、
、 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 A,B,C,D,E,F是原子序数依次增大的六种前四周期元素,其相关信息如表所示:
A,B,C,D,E,F是原子序数依次增大的六种前四周期元素,其相关信息如表所示:| A | 原子半径最小的元素 |
| B | 原子核外电子有6种不同的运动状态 |
| D | 原子L电子层上有2对成对电子 |
| E | E与D同主族 |
| F | 基态F+核外有3层电子且各层均处于全满状态 |
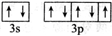 ;
;查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备1一溴丁烷的反应和实验装置如下:
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备1一溴丁烷的反应和实验装置如下:| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com