
科目: 来源: 题型:选择题
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓硫酸,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中的上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| (5)取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
| A. | 根据实验(1)可以确定溶液中不含有HCO3-和I-,因为这二个离子相对应的酸为弱酸 | |
| B. | 溶液中一定存在的离子是NO3-、SO42-、Cl-、Mg2+、Al3+;溶液中肯定不存在的离子是:Fe2+、HCO3-、I-、Ba2+ | |
| C. | 为进一步确定其它离子,应该补充焰色反应的实验来检验K+就可以 | |
| D. | 通过实验(1)和(2)就可以确定溶液中一定含有NO3-,一定不含有Fe2+、I-、HCO3-,所以实验步骤(4)的设计是错误的 |
查看答案和解析>>
科目: 来源: 题型:选择题
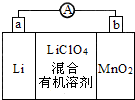
| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池正极反应式为MnO2+e-=MnO2- | |
| C. | 用稀硫酸代替有机溶剂,增加自由移动的离子浓度,可以增加电池的电流强度 | |
| D. | Li+通过电解质迁移入MnO2晶格中,生成LiMnO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | (CH3CH2)2CHCH3的正确命名是2-乙基丁烷 | |
| B. | 有机物大多是分子晶体,则乙醇的沸点和它相对分子质量相近的烷烃相差不多 | |
| C. | 鉴别淀粉、蛋白质、葡萄糖水溶液,依次可分别使用的试剂且对应的现象,碘水、变蓝色;硫酸铜溶液,白色沉淀;新制Cu(OH)2,加热后有砖红色沉淀 | |
| D. | 验证某有机物属于烃,应完成的实验内容是测定该试样的质量及试样完全燃烧后生成CO2和H2O的质量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锡中加入一定量的铅制成焊锡,目的使被焊接的部分更牢固,更不易被氧化 | |
| B. | 聚乙烯制成塑料薄膜,用于食品、药品包装的材料 | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 含重金属离子的电镀废液不能随意排放 |
查看答案和解析>>
科目: 来源: 题型:解答题
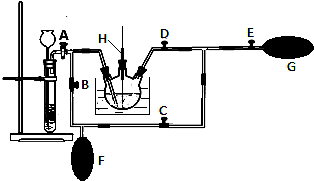
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 | |
| B. | 按系统命名法,有机物  的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 | |
| C. | 甲烷、甲醛、尿素都不存在同分异构体 | |
| D. | 某有机物含有C、H、O、N四种元素,其球棍模型为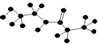 ,该有机物的结构简式为 ,该有机物的结构简式为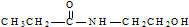 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 科学仪器的使用利于我们认识物质的微观世界,现在人们借助扫描隧道显微镜,应用STM技术可以“看”到越来越细微的结构,并实现对原子或分子的操纵 | |
| B. | 视频《穹顶之下》再次引起公众对“PM2.5”的关注.“PM2.5”是指大气中直径小于或等于2.5×10-6m的细小颗粒物,这些颗粒扩散在空气中形成胶体 | |
| C. | 臭氧是一种有鱼腥味、氧化性极强的淡蓝色气体,可用作自来水的消毒剂 | |
| D. | 我国油品从国 IV 汽油升级到国 V 汽油,有助于减少酸雨、雾霾,提高空气质量 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | NaCl | NaHCO3 | NH4Cl |
| 40℃时溶解度/g | 37 | 13 | 46 |
| 10℃时溶解度/g | 33 |
查看答案和解析>>
科目: 来源: 题型:解答题
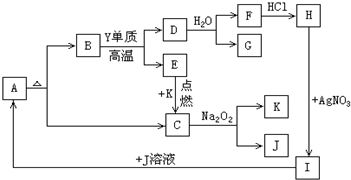
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com