
科目: 来源: 题型:选择题
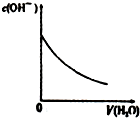 | 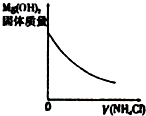 | 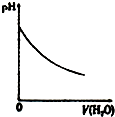 | 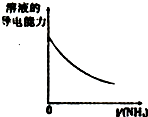 |
| A、盐酸加水稀释 | B、Mg(OH)2悬浊液中滴加NH4Cl溶液 | C、NH4Cl稀溶液加水稀释 | D、NH3通入醋酸溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a>b>c | B. | b>a>c | C. | c>b>a | D. | b>c>a |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 五种 | B. | 四种 | C. | 三种 | D. | 二种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室用大理石和稀盐酸反应制CO2:CO32-+2H+═CO2↑+H2O | |
| B. | Cl2通入石灰乳中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 氢氧化钠溶液腐蚀玻璃:2OH-+SiO2═SiO32-+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.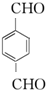 ;
; .
.查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D、E、F为前四周期原子序数依次增大的六种元素,A、C、D原子均有两个未成对电子,A、B、C同周期,A与D、B与F分别同主族,E是生活中用量最大的金属.请回答下列问题
A、B、C、D、E、F为前四周期原子序数依次增大的六种元素,A、C、D原子均有两个未成对电子,A、B、C同周期,A与D、B与F分别同主族,E是生活中用量最大的金属.请回答下列问题查看答案和解析>>
科目: 来源: 题型:解答题
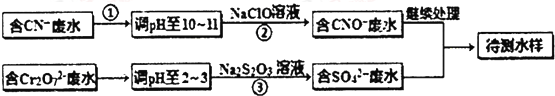
查看答案和解析>>
科目: 来源: 题型:解答题
| 操作过程 | 实验现象 |
| 将干燥纯净的CO2缓缓通过放有钠的已排尽空气的干燥玻璃管中,加热 | 钠燃烧,火焰为黄色 |
| 反应后冷却 | 管壁附有黑色颗粒和白色物质 |
| 实验步骤 | 实验现象 |
| ①少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加过量的CaC12溶液出现白色沉淀 | 出现白色沉淀 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
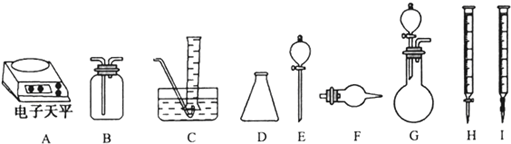
| 实验过程中发生反应的化学方程式 | 实验所需仪器(用字母表示) | 实验所需试剂(用字表示) | 实验需直接测定的有关物理量(用文字说明) |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com