
科目: 来源: 题型:选择题
| A. | 根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不与浓硫酸发生反应 | |
| B. | 过氧化钠可作为防毒面具和潜水艇内的供氧剂 | |
| C. | 可用稀硝酸鉴别铜锌合金制成的假金币 | |
| D. | 氢氟酸可用于雕刻玻璃 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液、胶体、浊液属于不同的分散系 | |
| B. | 胶体与其他分散系的本质区别是胶体分散质粒子直径在1nm-100nm之间 | |
| C. | 可利用丁达尔现象鉴别溶液和胶体 | |
| D. | 利用过滤的方法可以分离胶体和溶液 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

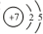 ,其单质的电子式为
,其单质的电子式为 ;
;查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 用甲图装置电解精炼镁 | |
| B. | 用乙图装置验证试管中铁丝发生析氢腐蚀 | |
| C. | 用丙图装置构成铜锌原电池 | |
| D. | 用丁图装置对充电电池进行充电 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 改变温度对反应速率无影响 | |
| B. | 升高温度能加快反应速率 | |
| C. | 使用催化剂能加快反应速率 | |
| D. | 该反应的化学方程式为:2CO+2NO═N2+2CO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 糖类、油脂和蛋白质都是高分子化合物 | |
| B. | 乙醇和乙酸都能与金属钠反应生成氢气 | |
| C. | 淀粉(C6H10O5)n和纤维素(C6H10O5)n互为同分异构体 | |
| D. | 石油的分馏和煤的干馏均只发生物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com