
科目: 来源: 题型:解答题
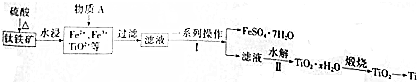
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 氯及其化合物在自来水消毒和果蔬保鲜等方面应用广泛.
氯及其化合物在自来水消毒和果蔬保鲜等方面应用广泛.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Mg2Al2(OH)4(CO3)3 | B. | Mg3Al2(OH)6(CO3)2 | C. | Mg3Al(OH)3(CO3)3 | D. | Mg3Al2(OH)8(CO3)2 |
查看答案和解析>>
科目: 来源: 题型:多选题
| 物质 | 除杂试剂 | 分离方法 | |
| A | 碳酸氢钠(碳酸钠) | - | 加热 |
| B | 二氧化碳(氯化氢) | 饱和Na2CO3 | 洗气 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 氧化铁(氧化铝) | NaOH溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
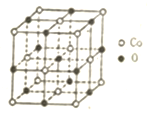 汽车安全气囊一般由传感器、气囊、气体发生器等组成.
汽车安全气囊一般由传感器、气囊、气体发生器等组成.查看答案和解析>>
科目: 来源: 题型:选择题
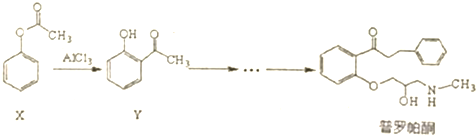
| A. | 普罗帕酮分子中有2个手性碳原子 | |
| B. | 可用溴水或FeCI3溶液鉴别X和Y | |
| C. | 反应物X与中间体Y互为同分异构体 | |
| D. | 普罗帕酮能发生加成、氧化、消去反应 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 铁螺丝连接锌板时,铁不容易生锈 | |
| B. | 反应CaC03(s)=Ca0(s)+C02(g)在常温下不能发生,则该反应的△H<0 | |
| C. | pH=11的NaOH溶液与pH=3的CH3COOH溶液混合后所得溶液pH小于7 | |
| D. | 电解精炼铜时,每转移1mol电子阳极上溶解的铜原子数小于0.5×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com