
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
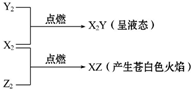 (1)铝热反应在工业生产中的重要用途之一是焊接钢轨或冶炼难熔金属等;用化学方程式表示出其中的原理2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe(举一例).铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸、碱破坏,若将表面有一层氧化铝薄膜的铝条和氢氧化钠溶液作用,反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O、2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(1)铝热反应在工业生产中的重要用途之一是焊接钢轨或冶炼难熔金属等;用化学方程式表示出其中的原理2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe(举一例).铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸、碱破坏,若将表面有一层氧化铝薄膜的铝条和氢氧化钠溶液作用,反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O、2Al+2NaOH+2H2O=2NaAlO2+3H2↑.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 足量CO2通入Na2SiO3溶液:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| B. | 醋酸与NaOH溶液反应:H++OH-═H2O | |
| C. | 氧化镁溶于稀硫酸:MgO+2H+═H2O+Mg2+ | |
| D. | 向AlCl3溶液中加入过量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2通入氯水后,溶液褪色且酸性减弱 | |
| B. | 是酸性氧化物,溶于水得稳定的亚硫酸 | |
| C. | SO2气体通入NaOH溶液一定得到Na2SO3 | |
| D. | S、SO2、SiO2三种物质均能与NaOH溶液反应,各自又能与某些酸反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活泼性决定 | |
| B. | Cu的湿法冶炼是将金属钠投入到CuSO4溶液中置换出铜 | |
| C. | 炼铁时加入石灰石的目的是除去过量的碳 | |
| D. | 由于Al的活泼性强,故工业上采用电解熔融AlCl3的方法生产Al |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 28gCO与N2的混合物中含有的分子总数为NA | |
| B. | 常温、常压下,22.4LO2中含有的O2分子数为NA | |
| C. | 1L1mol•L-1K2SO4溶液中含有的钾离子数为2NA | |
| D. | 过量的铁1molCl2充分反应时,铁失去的电子数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑤ | C. | 只有⑤ | D. | 只有② |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2SO4、NaOH、CaCO3、HCl都是强电解质 | |
| B. | Na2O2、CaO、MgO都是碱性氧化物 | |
| C. | 漂白粉、碘酒、小苏打都是混合物 | |
| D. | 烧碱、纯碱、熟石灰都是碱 |
查看答案和解析>>
科目: 来源: 题型:解答题
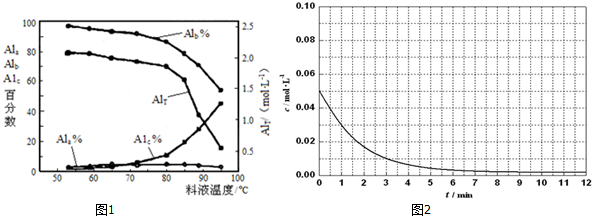
| AlT/(mol•L-1) | Ala/% | Alb/% | A1c/% |
| 0.208 | 1.4 | 86.6 | 12.0 |
| 0.489 | 2.3 | 86.2 | 11.5 |
| 0.884 | 2.3 | 88.1 | 9.6 |
| 1.613 | 3.1 | 87.0 | 9.9 |
| 2.520 | 4.5 | 88.2 | 7.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com