
科目: 来源: 题型:选择题
| X | Y | Z | |
| R | W | ||
| T |
| A. | 简单离子半径大小关系为:W>R>Z>Y | |
| B. | X有多种同素异形体,而Z不存在同素异形体 | |
| C. | R2W3可用RCl3溶液与Na2W溶液混合制取 | |
| D. | T的单质既能与盐酸反应又能与NaOH溶液反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理 | |
| B. | 解释化学反应速率理论有碰撞理论和过渡态理论,其中过渡态理论可解释温度、催化剂等因素对化学反应速率的影响 | |
| C. | 离子交换膜在工业上应用广泛,如氯碱工业使用阳离子交换膜 | |
| D. | 用氨水法处理燃煤烟气中的二氧化硫,既可消除其污染,又可得到副产品硫酸铵 |
查看答案和解析>>
科目: 来源: 题型:解答题
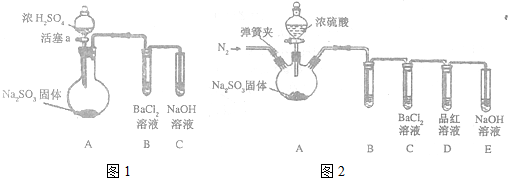
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
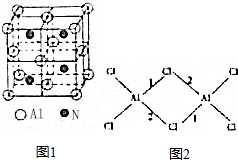
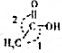 ,CH3COOH分子中σ键与π键个数之比7:1,分子中键角1<键角2(填“>”、“=”或“<”).
,CH3COOH分子中σ键与π键个数之比7:1,分子中键角1<键角2(填“>”、“=”或“<”).查看答案和解析>>
科目: 来源: 题型:解答题
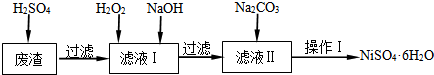
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
| 完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
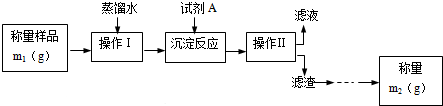
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com