
科目: 来源: 题型:选择题
| A. | ②④⑤⑥ | B. | ①⑤⑥ | C. | ①③⑤ | D. | 全部 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③④ | B. | ③④ | C. | ②③④ | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碘的升华、溴水中萃取溴、石油的分馏、煤的干馏均是物理变化 | |
| B. | BaSO4难溶于水是弱电解质,在医学上用作钡餐 | |
| C. | 14C可用于文物年代的鉴定,14C与12C互为同位素 | |
| D. | 明矾是常用的净水剂,可以杀菌、消毒 |
查看答案和解析>>
科目: 来源: 题型:解答题
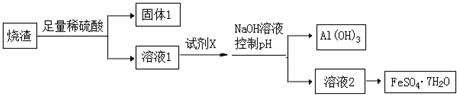
查看答案和解析>>
科目: 来源: 题型:解答题
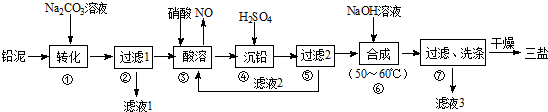
查看答案和解析>>
科目: 来源: 题型:解答题
 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下:查看答案和解析>>
科目: 来源: 题型:填空题
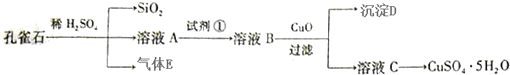
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:多选题
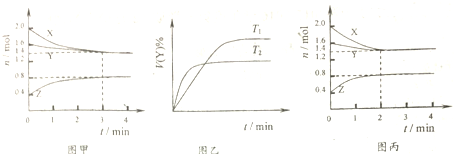
| A. | T1℃时,容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g),且正反应放热 | |
| B. | T1℃时,反应进行的前3min内,用X表示的反应速率v(X)=0.2mol•(L•min)-1 | |
| C. | T1℃时,3min达到平衡后,向容器中再加入2.0mol X、1.6mol Y、0.4mol Z,反应达到新平衡时:0.7mol•L-1<c(Y)<1.4mol•L-1 | |
| D. | 若改变反应条件,使反应进程如图丙所示,则改变的条件是使用催化剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 增大压强可提高反应速率 | |
| B. | 升高温度可减小反应速率 | |
| C. | 若反应物的总能量比生成物的总能量低,说明该反应是放热反应 | |
| D. | 增大氧气的浓度可使NO2转化率为100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com