
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
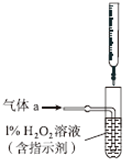 硫酸工业产生的废气(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气的组成进行探究,请回答下列问题:
硫酸工业产生的废气(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气的组成进行探究,请回答下列问题:
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡常数减小 | B. | CaO量不变 | C. | 氧气压强不变 | D. | CaO2量减少 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA | |
| B. | 0.1molZn与含0.1molHCl的盐酸充分反应,转移的电子数目为0.2NA | |
| C. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| D. | 向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,共转移的电子的数目为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
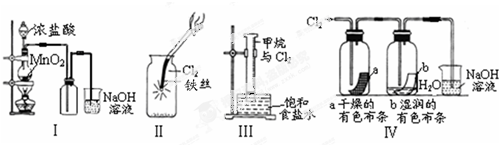
| A. | Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完 | |
| B. | Ⅱ图中:有棕黄色的雾生成 | |
| C. | Ⅲ图中:量筒中发生了加成反应 | |
| D. | Ⅳ图中湿润的有色布条能褪色,将浓硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHCO3溶液中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 紫色石蕊试液中滴入氢硫酸变红的原因是:H2S?2H++S2- | |
| C. | 等物质的量的MgCl2、Ba(OH)2和 HC1溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHCO3溶于水:NaHCO3═Na++H++CO32- | |
| B. | H2CO3?2H++CO32- | |
| C. | Al(OH)3酸式电离:Al(OH)3═H2O+AlO2-+H+ | |
| D. | NaHSO4熔化:NaHSO4═Na++HSO4- |
查看答案和解析>>
科目: 来源: 题型:选择题
 ②乙烯③SO2 ④氯乙烯
②乙烯③SO2 ④氯乙烯| A. | ①⑥⑦ | B. | ①③④⑥ | C. | ①④⑦ | D. | ①③⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com