
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 臭氧、活性炭处理水的原理相同 | |
| B. | 氯气是一种常用的消毒剂,用氯气消毒的水也可以用于配制各种化学试剂 | |
| C. | 氯气和二氧化硫都具有漂白性,等体积的两者混合会提高漂白的效率 | |
| D. | 漂白粉长期露置在空气中会失效 |
查看答案和解析>>
科目: 来源: 题型:解答题
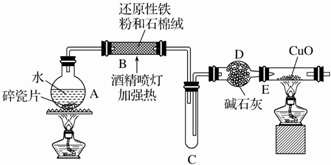
查看答案和解析>>
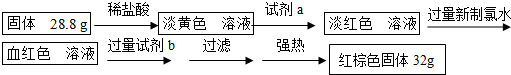
科目: 来源: 题型:解答题
查看答案和解析>>
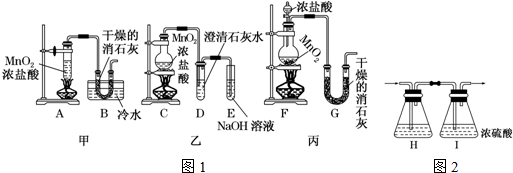
科目: 来源: 题型:解答题
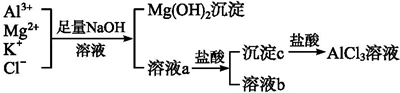
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaOH是氧化产物 | |
| B. | 当1molNaH发生反应时,该反应转移电子的物质的量为2mol | |
| C. | NaH为还原剂 | |
| D. | H2O既是还原剂又是氧化剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由于电流的作用,酸、碱、盐溶于水发生电离 | |
| B. | 胶体的分散质粒子直径小于l00nm但大于1nm | |
| C. | 存在自由移动的离子是电解质溶液导电的原因 | |
| D. | 醋酸溶液中存在H+、CH3COOH、CH3COO-等微粒,故醋酸是弱电解质 |
查看答案和解析>>
科目: 来源: 题型:解答题
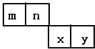 m、n、x、y四种主族元素在周期表里的相对位置如图所示,已知它们的原子序数总和为46,则:
m、n、x、y四种主族元素在周期表里的相对位置如图所示,已知它们的原子序数总和为46,则: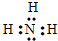 ,空间构型为三角锥形.
,空间构型为三角锥形.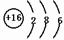 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com