
科目: 来源: 题型:选择题
| A. | c(HCO3-)=0.1mol•L-1的溶液中:Na+、K+、CO32-、Br- | |
| B. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| C. | pH=7的溶液中:Al3+、K+、Cl-、SO42- | |
| D. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
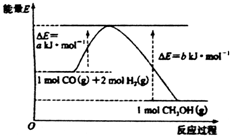
| A. | 该反应的活化能为a kJ•mol-1 | |
| B. | 1mol CO(g)和2 mol H2(g)的能量和大于1mol CH3OH(g)的能量 | |
| C. | 该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=(a-b)kJ•mol-1 | |
| D. | CO(g)+2H2(g)=CH3OH(1)△H=c kJ•mol-1c>(a-b) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 7.8g苯中碳碳双键的数目为0.3NA | |
| B. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-的个数为NA | |
| C. | 常温常压,11.2L NO和O2混合气体的原子数为NA | |
| D. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数为0.46NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X的化学式为AgS | B. | 银针验毒时,空气中氧气失去电子 | ||
| C. | 反应的还原剂是H2S | D. | 每生成1mo1X转移2mo1电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 英文的“中国”(China)又指“瓷器”,中国很早就应用化学技术制作陶瓷 | |
| B. | “四大发明”之一黑火药是由硫黄、硝石、木炭三种物质按一定比例配制的混合物 | |
| C. | 《淮南万毕术》中有“曾青得铁则化为铜”的记载,其含义是铁可从铜盐溶液中置换出铜 | |
| D. | 杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来 |
查看答案和解析>>
科目: 来源: 题型:解答题
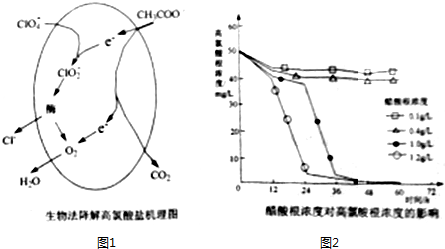
| 酸 | HClO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 1.6×10-9 | 4.2×10-10 |
查看答案和解析>>
科目: 来源: 题型:解答题
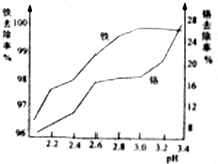 碱式硫酸铬可用于皮革、印染等行业.
碱式硫酸铬可用于皮革、印染等行业.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
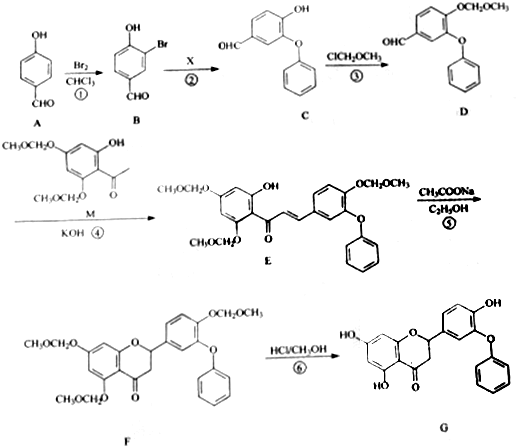
 .
.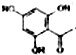 制得,写出同时满足下列条件的
制得,写出同时满足下列条件的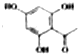 的一种同分异构体的结构简式
的一种同分异构体的结构简式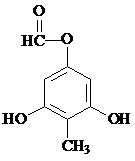 或
或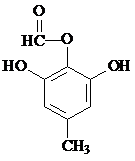 .
. 为原料,合成
为原料,合成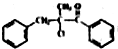 ,写出合成流程图
,写出合成流程图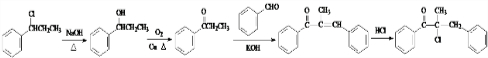 (无机试剂作用).合成流程图示例如下:CH2-CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
(无机试剂作用).合成流程图示例如下:CH2-CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com