
科目: 来源: 题型:选择题
| A. | K+ MnO4- Na+ Cl- | B. | K+ Na+ NO3- CO32- | ||
| C. | Na+ H+ NO3- SO42- | D. | Fe3+ Na+ Cl- SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在常温常压下,11.2 升氯气含有的分子数为0.5NA | |
| B. | 1 molFe与足量的Cl2反应转移的电子数为2NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 标准状况下,22.4 LSO3含有的原子数为4NA |
查看答案和解析>>
科目: 来源: 题型:解答题
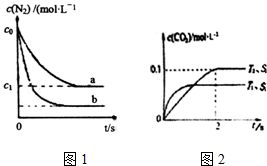 汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.
汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(×10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/(×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 产生白色沉淀反应的离子方程式为:2Cu2++4I-=2CuI↓+I2 | |
| B. | 通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 | |
| C. | 上述实验条件下,物质的氧化性强弱顺序为:Cu2+>I2>SO2 | |
| D. | 滴加KI溶液时,每生成1mol CuI转移1mol e- |
查看答案和解析>>
科目: 来源: 题型:选择题
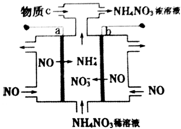
| A. | b为阳极,连接电源的正极 | |
| B. | 阴极反应式为3NO+15e-+18H+═3NH4++3H2O | |
| C. | 为使电解产物全部转化为NH4NO3,需补充的物质c为HNO3 | |
| D. | 总反应式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2NHO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤 | |
| B. | KNO3固体中混有少量NaCl:加H2O配制热的饱和溶液,再冷却结晶、过滤 | |
| C. | 乙醇中的少量水:加入适量新制的生石灰,加热蒸馏 | |
| D. | 二氧化碳中混有少量一氧化碳:点燃除去 |
查看答案和解析>>
科目: 来源: 题型:选择题
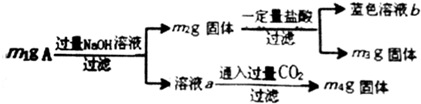
| A. | 由m1、m2、m4可计算出混合物中Al、Al2O3的物质的量 | |
| B. | 生成蓝色溶液的离子方程式为Cu+2Fe3+=Cu2++2Fe2+ | |
| C. | 蓝色溶液中一定有Cu2+、Fe2+、Fe3+ | |
| D. | 当m2-m3=2.96g时,Fe3O4的质量至少为2.32g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该消毒液的pH约为13:ClO-+H2O?HClO+OH- | |
| B. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++Cl-+ClO-═Cl2↑+H2O | |
| D. | 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-═HClO+CH3COO- |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验目的和操作 | 影响结果 | 原因分析 |
| A | 将2g I2加入到98mLCCl4中溶解混匀后,配制质量分数为2% I2的CCl4溶液 | 偏小 | CCl4的密度大于1g•mL-1 |
| B | 用10mL的量筒测量酯化反应得到乙酸乙酯的体积,俯视液面读出数据为6.0mL | 偏小 | 平视读取应大于6.0mL |
| C | 配制2mol•L-1NaCl溶液,定容时加入的水超过了刻度线,立即用滴管吸出多余的水,再摇匀 | 无影响 | 吸出了多余的水 |
| D | 用尖嘴有气泡的碱式滴定管盛标准NaOH溶液滴定20.00mL某待测HCl溶液的浓度 | 偏大 | 流出碱液的量 变大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单质的沸点:W>X | B. | Y的最高化合价为+7 | ||
| C. | 原子半径:r(W)<r(X)<r(Y)<r(Z) | D. | W、X、能存在于同一离子化合物中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com