
科目: 来源: 题型:选择题
| A. | 玉是石灰石 | B. | 玉的硬度比河砂大 | ||
| C. | 玉的熔点较高 | D. | 玉是金刚砂 |
查看答案和解析>>
科目: 来源: 题型:选择题
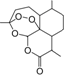 我国女科学家屠呦呦的名字出自《诗经•小雅》:“呦呦鹿鸣,食野之蒿.我有嘉宾,德音孔昭”,她因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖.下列有关青蒿素的叙述错误的是( )
我国女科学家屠呦呦的名字出自《诗经•小雅》:“呦呦鹿鸣,食野之蒿.我有嘉宾,德音孔昭”,她因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖.下列有关青蒿素的叙述错误的是( )| A. | 分子式为C15H20O5 | B. | 易溶于C2H5OC2H5 | ||
| C. | 官能团有醚键和酯基 | D. | 能与NaOH溶液反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 序号 | 主要实验步骤及实验现象 |
| ① | 在含Y的溶液中,加入稀硫酸放置,产生浅黄色沉淀和无色有刺激性气味的气体,该气体可使品红溶液褪色 |
| ② | 在含Z的溶液中,滴加盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀 |
| ③ | 将实验②最终得到的混合物加热蒸发、灼烧,最终得到白色固体 |
查看答案和解析>>
科目: 来源: 题型:解答题
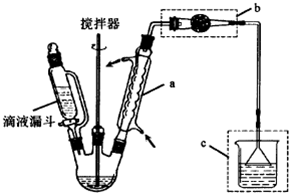
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的BaCl2溶液 | 出现白色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ;
; 2NH3;
2NH3;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | KCl、KOH、K2CO3、KHCO3 | B. | K2CO3、KOH、K2O2、KHCO3 | ||
| C. | K2SO3、KOH、K2O2、KHCO3 | D. | KHCO3、KOH、K2O2、K2CO3 |
查看答案和解析>>
科目: 来源: 题型:解答题
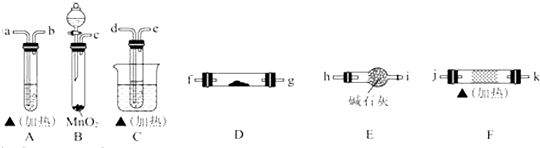
查看答案和解析>>
科目: 来源: 题型:解答题
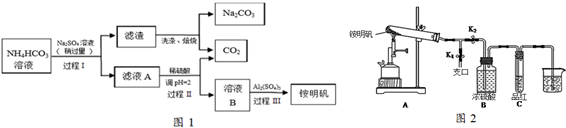
查看答案和解析>>
科目: 来源: 题型:解答题
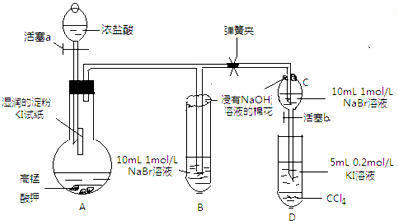 某研究性学习小组进行如下探究活动:
某研究性学习小组进行如下探究活动:| 水 | 四氯化碳 | |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com