
科目: 来源: 题型:解答题

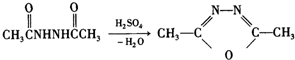
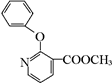 +H2N-NH2→
+H2N-NH2→ ,
, ,
,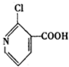 有多种同分异构体,其中符合下列条件的同分异构体共有4种.
有多种同分异构体,其中符合下列条件的同分异构体共有4种.查看答案和解析>>
科目: 来源: 题型:解答题
 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
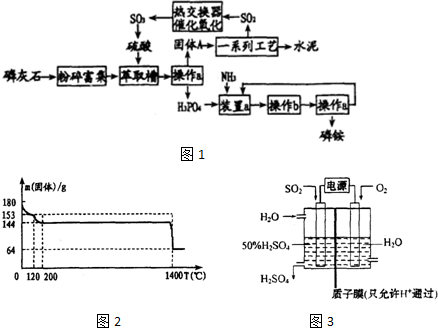
查看答案和解析>>
科目: 来源: 题型:解答题
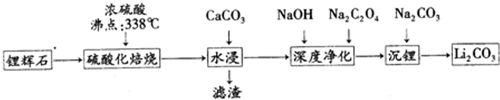
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
科目: 来源: 题型:解答题
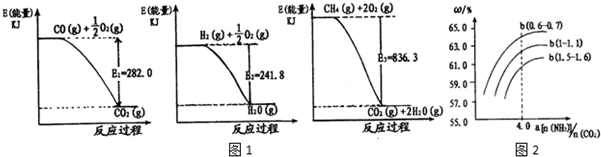
| 时间 | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
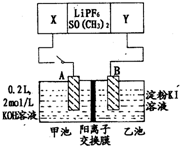 已知高能锂电池的总反应式为:2Li+FeS═Fe+Li2S[LiPF6.SO( CH3)2为电解质],用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下H2 4.48L.下列有关叙述不正确的是( )
已知高能锂电池的总反应式为:2Li+FeS═Fe+Li2S[LiPF6.SO( CH3)2为电解质],用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下H2 4.48L.下列有关叙述不正确的是( )| A. | 从隔膜中通过的离子数目为0.4 NA | |
| B. | 若电解过程体积变化忽略不计,则电解后甲池中溶液浓度为4 mol/L | |
| C. | A电极为阳极 | |
| D. | 电源正极反应式为:FeS+2Li++2e-═Fe+Li2S |
查看答案和解析>>
科目: 来源: 题型:选择题
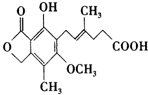 ,下列有关麦考酚酸说法不正确的是( )
,下列有关麦考酚酸说法不正确的是( )| A. | 分子式为C17H20O6 | |
| B. | 能与FeCl3溶液显色,与浓溴水反应,最多消耗量1 mol Br2 | |
| C. | 1mol麦考酚酸最多与3 mol NaOH反应 | |
| D. | 在一定条件下可发生加成,加聚,取代,消去四种反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Y、Z、W单核离子均能破坏水的电离平衡 | |
| B. | W元素氧化物对应水化物的酸性一定强于Z | |
| C. | 含X、Y、Z三种元素组成的化合物不止2种 | |
| D. | 因为X的氢化物分子间有氢键,所以X的氢化物较Z的氢化物稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com