
科目: 来源: 题型:选择题
| A. | 3.65g | B. | 7.3g | C. | 10.95g | D. | 14.6g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可将固体或浓溶液直接在容量瓶中溶解或稀释 | |
| B. | 氯化钠溶解于水,形成能够自由移动的水合钠离子和水合氯离子 | |
| C. | 失去电子越多的氧化剂,其氧化性就越强 | |
| D. | 物质的量浓度相等的盐酸和醋酸,导电能力相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定呈碱性 | |
| C. | 某无色溶液中加入BaCl2溶液,再加稀盐酸,沉淀不溶解,原溶液中一定有SO42- | |
| D. | 某无色溶液中加入酚酞试液变红,该溶液一定是碱溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 发生了颜色变化的一定是化学变化 | |
| B. | 有气泡产生或固体析出的变化一定是化学变化 | |
| C. | 用糯米、酒曲和水制成甜酒酿一定是化学变化 | |
| D. | 氧化还原反应中肯定有一种元素被氧化,而另一种元素被还原 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知K=$\frac{{c}^{2}C{O}_{2}•{c}^{6}•{H}_{2}}{{c}^{3}{H}_{2}O•cC{H}_{3}C{H}_{2}OH}$,则对应的化学反应可以表示为2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g) | |
| B. | 将某浓度氢氟酸溶液升高温度,氢氟酸的电离度(α)和电离平衡常数Ka都变大 | |
| C. | 常温下,向纯水中加入碳酸钠,水的电离程度变大,KW变大 | |
| D. | 化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变 |
查看答案和解析>>
科目: 来源: 题型:解答题
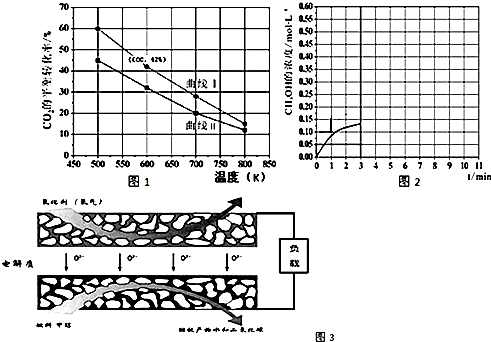
查看答案和解析>>
科目: 来源: 题型:解答题
| 时间/min 浓度 物质 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol•L-1 | 0.13mol•L-1 | 0.1mol•L-1 | 0.1mol•L-1 | 0.09mol•L-1 |
| H2 | 0mol•L-1 | 0.2mol•L-1 | 0.3mol•L-1 | 0.3mol•L-1 | 0.33mol•L-1 |
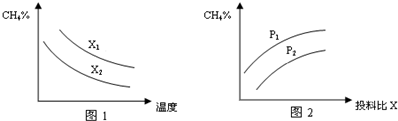
查看答案和解析>>
科目: 来源: 题型:选择题
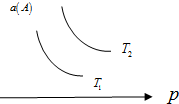 在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )
在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )| A. | a+b<c | |
| B. | 若T2>T1,则该反应在高温下易自发进行 | |
| C. | △H>0 | |
| D. | 若T2<T1,则该反应一定不能自发进行 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 温度、容积不变,充入NH3 | B. | 温度、容积不变时,充入SO2气体 | ||
| C. | 充入N2,保持压强不变 | D. | 移走一部分NH4HS固体 |
查看答案和解析>>
科目: 来源: 题型:解答题
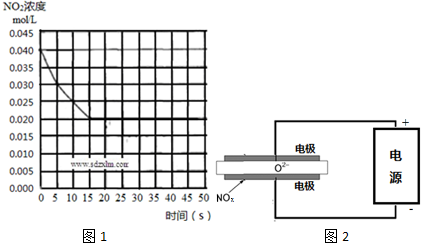
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com