
科目: 来源: 题型:解答题
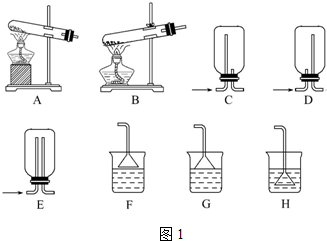
查看答案和解析>>
科目: 来源: 题型:选择题
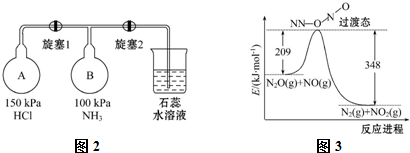
| A. | 4.5 mol HCl | B. | 2.5 mol H2O | ||
| C. | 108.5 g 33.6%的盐酸 | D. | 145 g 50.3%的盐酸 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | NaOH溶液可以用氨水来代替 | |
| B. | 溶液a中含有Al3+、K+、Cl-、Na+、OH- | |
| C. | 溶液b中只含有NaCl | |
| D. | 向溶液a中滴加盐酸需控制溶液的pH |
查看答案和解析>>
科目: 来源: 题型:选择题
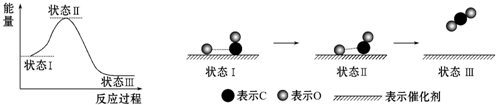
| A. | CO和O生成CO2是吸热反应 | |
| B. | 在该过程中,CO断键形成C和O | |
| C. | 状态Ⅰ→状态Ⅲ表示CO和O反应生成CO2的过程 | |
| D. | 状态Ⅰ→状态Ⅲ表示CO与O2反应生成CO2的过程 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 55 kJ | B. | 220 kJ | C. | 550 kJ | D. | 1 108 kJ |
查看答案和解析>>
科目: 来源: 题型:填空题
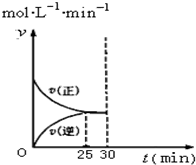 实验室模拟SO2与O2在一定条件下反应生成SO3.现将1.00mol SO2与1.00mol O2置于一体积不变的1L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-l.在其他条件不变的情况下,不同温度时SO3的浓度(mol•L-1)随时间(min)的变化如表格所示:
实验室模拟SO2与O2在一定条件下反应生成SO3.现将1.00mol SO2与1.00mol O2置于一体积不变的1L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-l.在其他条件不变的情况下,不同温度时SO3的浓度(mol•L-1)随时间(min)的变化如表格所示: 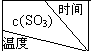 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| T1 | 0 | 0.20 | 0.30 | 0.39 | 0.47 | 0.50 | 0.50 |
| T2 | 0 | 0.25 | 0.40 | 0.40 | 0.40 | 0.40 | 0.40 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
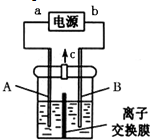 加“碘”食盐实际添加的是碘酸钾.以石墨和铁为电极,以KI溶液为电解液在一定条件下电解可制得KIO3,其简易装置如图所示.已知:3I2+6OH-═IO3-+5I-+3H2O.通电前若加入少量淀粉溶液,通电后发现右侧溶液变蓝色,一段时间后蓝色逐渐变浅.
加“碘”食盐实际添加的是碘酸钾.以石墨和铁为电极,以KI溶液为电解液在一定条件下电解可制得KIO3,其简易装置如图所示.已知:3I2+6OH-═IO3-+5I-+3H2O.通电前若加入少量淀粉溶液,通电后发现右侧溶液变蓝色,一段时间后蓝色逐渐变浅.查看答案和解析>>
科目: 来源: 题型:填空题
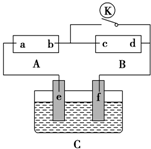 如图所示,A为直流电源,B为浸透饱和硫酸钠溶液和紫色石蕊溶液的滤纸,C为电镀池,接通电路后,发现B上的c点显蓝色,请填空:
如图所示,A为直流电源,B为浸透饱和硫酸钠溶液和紫色石蕊溶液的滤纸,C为电镀池,接通电路后,发现B上的c点显蓝色,请填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com