
科目: 来源: 题型:选择题
| A. | 稳定性:Na2CO3>NaHCO3 | B. | 熔点:生铁>纯铁 | ||
| C. | 酸性:H2CO3>HClO | D. | 氧化性:Fe3+>Cu2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2CO3、H2SiO3、HClO都属于弱酸 | B. | Na2O、MgO、Al2O3都属于碱性氧化物 | ||
| C. | 石英、纯碱、明矾都属于盐 | D. | 碱石灰、铁红、水泥都属于混合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ) 是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如图:
) 是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如图: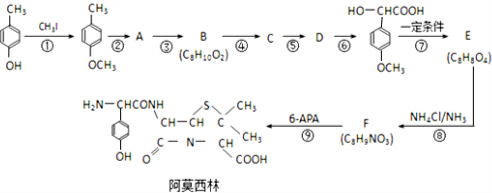
 $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$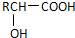
 ;
; 的一种同分异构体的一氯代物的结构为
的一种同分异构体的一氯代物的结构为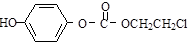 ,该物质在NaOH水溶液中加热反应反应时的化学方程式为
,该物质在NaOH水溶液中加热反应反应时的化学方程式为 ;
; 满足以下条件的同分异构体有3种.
满足以下条件的同分异构体有3种.查看答案和解析>>
科目: 来源: 题型:解答题
 )过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图:
)过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图:
 +2H2O→2
+2H2O→2 +H2O2;
+H2O2; )能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称苯甲酸乙酯;
)能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称苯甲酸乙酯;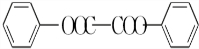 (或
(或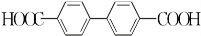 或
或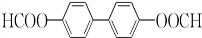 .;
.;查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题
 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )| A. | 正反应为吸热反应 | B. | 平衡常数:KA>KB | ||
| C. | 反应速率:vB>vC | D. | W点时,v正>v逆 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com