
科目: 来源: 题型:选择题
| A. | 电池工作时,电子由正极通过外电路流向负极 | |
| B. | 电池工作时,阳离子向负极移动 | |
| C. | 放电时Zn参与反应的电极为正极 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应是放热还是吸热必须看生成物和反应物所具有的总能量的相对大小 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能储存起来 | |
| C. | 吸热反应都要加热才能进行 | |
| D. | 物质的化学能可以在一定条件下转化为热能、电能为人类所利用 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烯和苯都能与溴水反应 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | 有机物分子中都存在碳碳单键 | |
| D. | 乙醇可以被氧化为乙酸,二者都能发生酯化反应 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
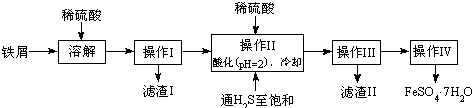
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
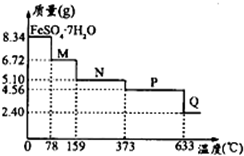
查看答案和解析>>
科目: 来源: 题型:解答题
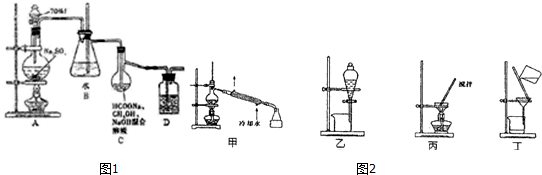
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液中先滴加足量盐酸无规象,再滴加BaCl2溶液有白色沉淀.则原溶液中有SO42- | |
| C. | 某无色溶液滴入酚酞试液显红色,该溶液一定是含有大量的H+ | |
| D. | 某溶液中滴加盐酸生成能使澄清石灰水变浑浊的无色气体,说明原溶液中有CO32- |
查看答案和解析>>
科目: 来源: 题型:解答题
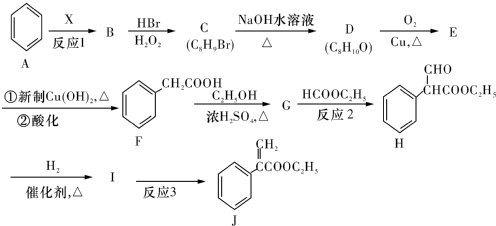
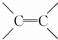 (或碳碳双键).
(或碳碳双键). .
.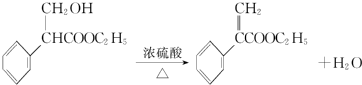 .
.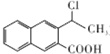 为起始原料制备
为起始原料制备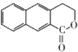 的合成路线
的合成路线 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com