
科目: 来源: 题型:选择题
| A. | 三种酸的电离常数:Ki1(H2CO3)>Ki(HX)>Ki(HY)>Ki2(H2CO3) | |
| B. | NaX溶液中通入足量CO2后的离子浓度:c(HCO3-)>c(CO32-)>c(X-) | |
| C. | 同浓度溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| D. | 结合H+的能力:Y->CO32->X->HCO3- |
查看答案和解析>>
科目: 来源: 题型:多选题

| A. | 3种单体通过缩聚反应聚合 | B. | 形成该化合物的单体只有2种 | ||
| C. | 其中一种单体为 | D. | 其中一种单体为1,5-二甲基苯酚 |
查看答案和解析>>
科目: 来源: 题型:解答题
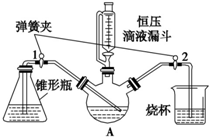 某化学兴趣小组用下图实验装置进行醋酸亚铬的制备研究.已知:醋酸亚铬(其中铬元素为二价)是红棕色晶体,不溶于水,在潮湿时,Cr2+极易被氧化成 Cr3+.(备注:Cr2+在溶液中为蓝色).
某化学兴趣小组用下图实验装置进行醋酸亚铬的制备研究.已知:醋酸亚铬(其中铬元素为二价)是红棕色晶体,不溶于水,在潮湿时,Cr2+极易被氧化成 Cr3+.(备注:Cr2+在溶液中为蓝色).
查看答案和解析>>
科目: 来源: 题型:解答题
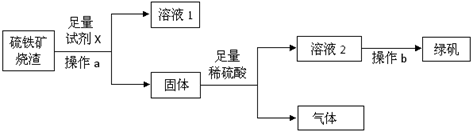
查看答案和解析>>
科目: 来源: 题型:选择题
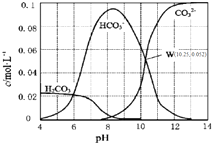 25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )
25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )| A. | 在pH=7.0时,溶液中含碳粒子只有CO32-和HCO3- | |
| B. | 向Na2CO3溶液中通入HCl气体,立即产生CO2气体 | |
| C. | H2CO3的Ka2=1.0×10-10.25 | |
| D. | 向100 mL 0.1 mol•L-1碳酸钠溶液中滴加盐酸至溶液pH=4.0,生成CO2气体224 mL |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1L0.1mol/L乙酸溶液中 H+数为0.1NA | |
| B. | 16g甲烷分子中所含质子数为10NA | |
| C. | 0.1molCnH2n+2中含有的C-C键数为0.1nNA | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| R | ||
| X | T | Z |
| Q |
| A. | X的最高价氧化物能溶于强碱 | B. | 非金属性:T>R | ||
| C. | 单质导电性:Z>T>X | D. | R与Q的原子核外电子数相差16 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N2+3Mg$\frac{\underline{\;点燃\;}}{\;}$Mg3N2 | B. | N2+3H2$?_{催化剂}^{高温、高压}$2NH3 | ||
| C. | 2NO+O2═2NO2 | D. | N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.25(b-2a)mol/L | B. | 4(2a-b)mol/L | C. | 2(b-2a)mol/L | D. | 4(b-2a)mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com