
科目: 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 除去混在NO2中的NO:将气体与足量O2混合 | |
| B. | 除去混在CO2中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸 | |
| C. | 除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤 | |
| D. | 除去乙酸中混有的乙醇:加入金属钠后蒸馏 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向某溶液中加入稀盐酸,产生无色无味且能使石灰水变浑浊的气体,该溶液一定含有CO32- | |
| B. | 用洁净的铂丝蘸取少量某溶液在无色火焰上灼烧,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 向某溶液中加入BaCl2溶液,有沉淀生成,再加入稀盐酸,沉淀不消失,该溶液一定含有SO42- | |
| D. | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
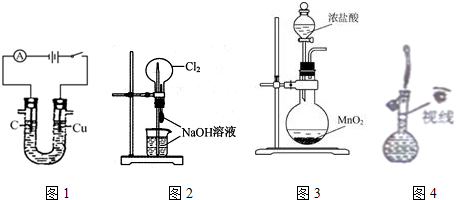
| A. | 图1装置可以用来电解制氢气和氯气 | |
| B. | 图2装置可以完成“喷泉”实验 | |
| C. | 图3装置可以用来实验室制氯气 | |
| D. | 图4装置可以用来配制一定物质的量浓度的氯化钠溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
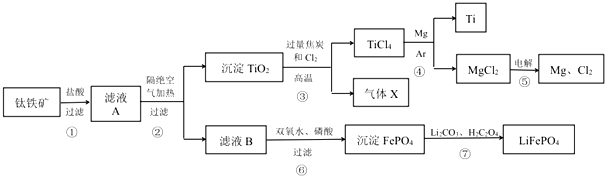
查看答案和解析>>
科目: 来源: 题型:解答题
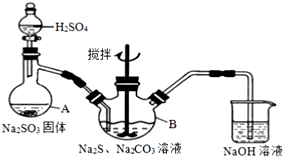 硫代硫酸钠(Na2S2O3)是一种重要的化工产品.某兴趣小组在查阅资料后制备Na2S2O3,结合其性质进行了实验探究.
硫代硫酸钠(Na2S2O3)是一种重要的化工产品.某兴趣小组在查阅资料后制备Na2S2O3,结合其性质进行了实验探究.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| B. | 加入氢氧化钠溶液,先产生白色沉淀,后迅速变为灰绿色,最后变为红褐色,一定有Fe2+ | |
| C. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| D. | 加入硝酸银溶液产生白色沉淀,再加稀硝酸,白色沉淀不溶解,一定有Ag+ |
查看答案和解析>>
科目: 来源: 题型:解答题
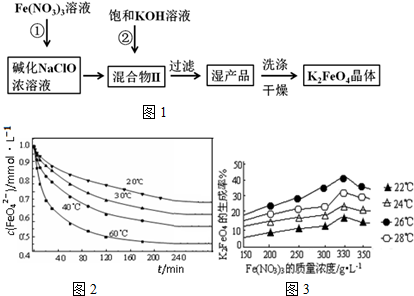
查看答案和解析>>
科目: 来源: 题型:解答题
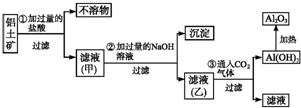 工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示:
工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com