
科目: 来源: 题型:填空题

| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
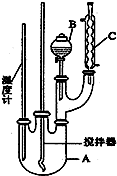
查看答案和解析>>
科目: 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 0~2 min的平均速率v(Z)=2.0×10-3 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡时v(正)>v(逆) | |
| C. | 该温度下此反应的平衡常数K=144 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 浓度 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
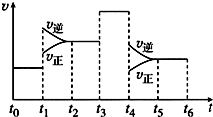 300℃下,将2mol SO21mol O2混合于2L的恒容密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H,2分钟末达到平衡,测得SO2的转化率为60%,请根据化学反应的有关原理回答下列问题:
300℃下,将2mol SO21mol O2混合于2L的恒容密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H,2分钟末达到平衡,测得SO2的转化率为60%,请根据化学反应的有关原理回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高温度和增大压强 | B. | 降低温度和减小压强 | ||
| C. | 降低温度和增大压强 | D. | 升高温度和减小压强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cu和Cu2O的物质的量之比为2:1 | |
| B. | 产生的NO在标准状况下的体积为4.48L | |
| C. | 硝酸的物质的量浓度为2.6mol•L-1 | |
| D. | Cu和Cu2O与硝酸反应后剩余HNO3为0.2mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol•L-1的FeCl3溶液中:HCO3-、K+、SO42-、Br- | |
| B. | 滴入酚酞试液显红色的溶液中:NH4+、SO42-、Fe2+、Cl- | |
| C. | 通入大量SO2的溶液中:Na+、Cl-、S2-、SO42- | |
| D. | pH=1的溶液中:Mg2+、Ca2+、NO3-、Ag+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 五种元素的原子半径从大到小的顺序是:Z>W>M>Y>X | |
| B. | 氢化物的还原性:Y>M>W | |
| C. | Y和M的氧化物都是酸性氧化物 | |
| D. | X2Z的电子式为: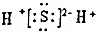 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com