
科目: 来源: 题型:解答题
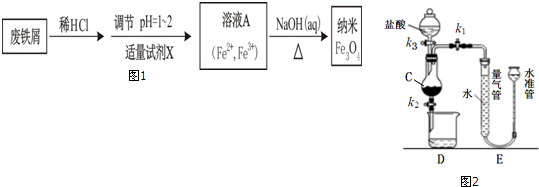
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C2O3和CO2是同素异形体 | B. | C2O3和CO完全燃烧,产物都是CO2 | ||
| C. | C2O3和CO都是酸性氧化物 | D. | C2O3和CO2互为同分异构体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| B. | 二氧化碳、甲烷、氮气都是造成温室效应的气体 | |
| C. | 在工业生产中,研制出在较低温度和压强下能使反应迅速进行的催化剂,可起到很好的节能效果,能体现十八大提出的“绿色发展”理念 | |
| D. | 石油裂解、煤的气化、海水制镁都包含化学变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属钠与水反应比金属钠与甲醇反应更剧烈 | |
| B. | 结合H+的能力CH3O-<OH- | |
| C. | 所得到溶液中K=c(CH3O-)×c(CH3OH2+) | |
| D. | 所得到溶液中c(Na+)+c(CH3OH2+)═c(CH3O-) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
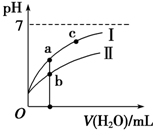 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 25℃时,相同浓度的CH3COONa溶液的碱性大于NaClO溶液 | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为2ClO-+CO2+H2O═2HClO+CO${\;}_{3}^{2-}$ | |
| C. | 图象 I代表CH3COOH溶液的稀释 | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
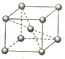 有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素.X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G的阳离子是胆矾晶体中的中心离子.回答下列问题:
有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素.X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G的阳离子是胆矾晶体中的中心离子.回答下列问题: .
.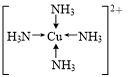 (写在方框内).
(写在方框内).
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com