
科目: 来源: 题型:解答题
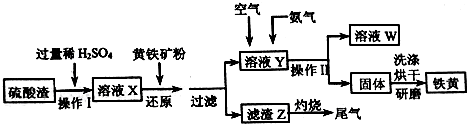
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①⑤ | B. | ①④ | C. | ③⑥ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2L0.5mol/L亚硫酸钠溶液中含有的H+离子数为2NA | |
| B. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
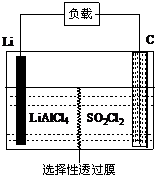 为了国防现代化,某军事科研所研发了一种新型的Li-SO2Cl2军用电池,其组成结构示意图如图所示.已知电池总反应为:2Li+SO2Cl2═2LiCl+SO2↑.下列说法中不正确的是( )
为了国防现代化,某军事科研所研发了一种新型的Li-SO2Cl2军用电池,其组成结构示意图如图所示.已知电池总反应为:2Li+SO2Cl2═2LiCl+SO2↑.下列说法中不正确的是( )| A. | 电池的负极反应为:2Li-2e-═2Li+ | |
| B. | 工作时电流方向:锂电极→导线→负载→碳棒 | |
| C. | 正极电极反应为:SO2Cl2+2e-═2Cl-+SO2↑ | |
| D. | 电池工作时,会在碳棒表面看到气泡产生 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入少量稀H2SO4,在管口观察到红棕色气体 | 溶液中NO3-被Fe2+还原成NO2 |
| B | 用铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色 | 该溶液一定是钠盐溶液 |
| C | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 有NaHCO3晶体析出 |
| D | 常温下,将Al箔插入浓硫酸中,无明显现象 | 铝和浓硫酸常温不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | KIO3与KI在酸性溶液中反应:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 向碳酸氢铵溶液中加过量氢氧化钠溶液并加热:NH4++OH-═NH3↑+H2O | |
| C. | Na[Al(OH)4]-溶液中通入过量CO2制Al(OH)3:CO2+[Al(OH)4]-═Al(OH)3↓+HCO3- | |
| D. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯气通入氢氧化钠溶液中:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 某溶液中只存在SO42-、OH-、NH4+、H+四种离子,则可能存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
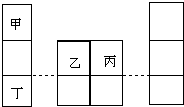 短周期元素甲、乙、丙、丁在元素周期表中的相对位置如图所示,其中甲是原子半径最小的元素,丙原子最外层有6个电子.下列说法正确的是( )
短周期元素甲、乙、丙、丁在元素周期表中的相对位置如图所示,其中甲是原子半径最小的元素,丙原子最外层有6个电子.下列说法正确的是( )| A. | 简单离子半径:r(丁)>r(乙)>r(丙) | |
| B. | 元素丙的简单气态氢化物的热稳定性比乙的强 | |
| C. | 仅由甲、乙、丙三种元素形成的化合物的水溶液一定呈酸性 | |
| D. | 丙和丁形成的两种化合物中阴阳离子个数比不同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 能使石蕊试液变红色的溶液中:Na+、CO32-、K+、ClO-、I- | |
| B. | 能与金属铝反应放出H2的溶液中:K+、NO3-、Cl-、NH4+ | |
| C. | 常温下水电离出的c(H+)•c(OH-)=10-20mol/L的溶液中:Na+、Cl-、S2-、SO32- | |
| D. | 中性溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com