
科目: 来源: 题型:解答题
| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO32-、AlO2- |
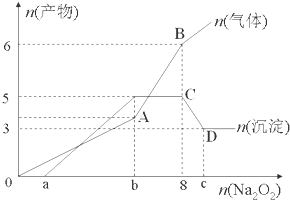
查看答案和解析>>
科目: 来源: 题型:解答题
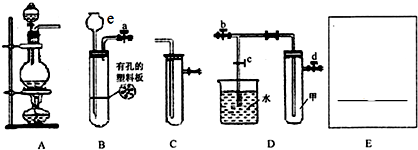
查看答案和解析>>
科目: 来源: 题型:解答题
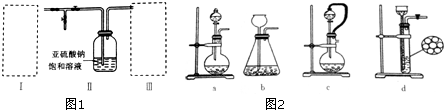
查看答案和解析>>
科目: 来源: 题型:解答题
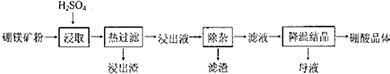
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
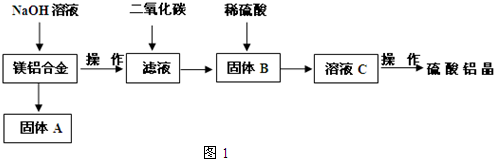
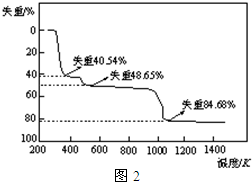 (5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见图2,已知:失重%=$\frac{加热减少的质量}{原晶体样品的总质量}$×100%.根据图示数据计算确定每步分解的产物,写出第一阶段分解产物的化学式Al2(SO4)3.3H2O,第三阶段反应化学方程式Al2(SO4)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3SO3↑.
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见图2,已知:失重%=$\frac{加热减少的质量}{原晶体样品的总质量}$×100%.根据图示数据计算确定每步分解的产物,写出第一阶段分解产物的化学式Al2(SO4)3.3H2O,第三阶段反应化学方程式Al2(SO4)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3SO3↑.查看答案和解析>>
科目: 来源: 题型:解答题
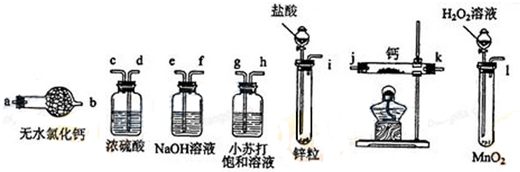
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com