
科目: 来源: 题型:选择题
| A. | 所用HNO3为浓度为10mol/L | B. | NO的体积为6.72升 | ||
| C. | NO2的体积为3.36升 | D. | 被还原的HNO3为1mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.2mol | B. | 1.2mol | C. | 0.6mol | D. | 1.0mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将少量的两种白色固体分别加入1 mol/L的盐酸中,看有无气泡产生 | |
| B. | 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 | |
| C. | 分别取样配成溶液,滴加BaCl2溶液,观察有无白色沉淀 | |
| D. | 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色 |
查看答案和解析>>
科目: 来源: 题型:解答题
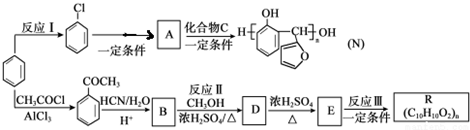
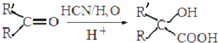
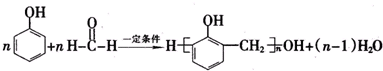
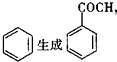 的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•
的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•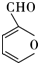
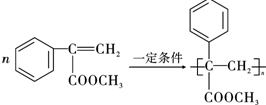
 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
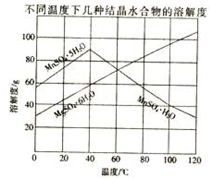 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 稀醋酸中加入少量冰醋酸能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的盐酸与氨水混合后,溶液pH=7 | |
| C. | 0.1 mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) | |
| D. | 25℃时,0.1mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 |
查看答案和解析>>
科目: 来源: 题型:选择题
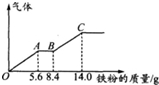 -定浓度H2SO4、HNO3混合后的稀溶液100mL,向其中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示,假设且每一段只对应一个反应,则OA段产生的气体和H2SO4的物质的量浓度分别为( )
-定浓度H2SO4、HNO3混合后的稀溶液100mL,向其中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示,假设且每一段只对应一个反应,则OA段产生的气体和H2SO4的物质的量浓度分别为( )| A. | NO,1.5mol/L | B. | H2,1.5mol/L | C. | NO,2.5mol/L | D. | H2,2.5mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
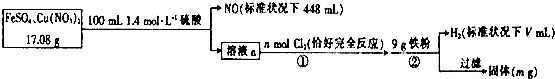
| A. | V=2240 | |
| B. | n=0.02 | |
| C. | 原混合物中FeS04的质量分数约为89% | |
| D. | m=0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com