
科目: 来源: 题型:选择题
| A. | 苏打--NaHCO3 | B. | 胆矾--ZnSO4 | C. | 酒精--C2H5OH | D. | 生石灰--Ca(OH)2 |
查看答案和解析>>
科目: 来源: 题型:解答题
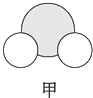 | 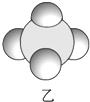 |  |
| 是地球上最常见的物质之一,常温为液态,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分 | 无色,无味且易燃,是21世纪的主要能源 | 弱酸,有强氧化性,可以用于消毒杀菌 |
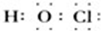 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl.
,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl.查看答案和解析>>
科目: 来源: 题型:解答题
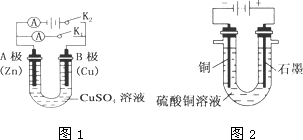 请按要求回答下列问题.
请按要求回答下列问题.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.100 mol | D. | 0.200 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
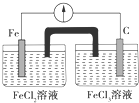
| A. | Fe是负极,C是正极 | B. | 负极反应式:Fe-3e-═Fe3+ | ||
| C. | 内电路中阴离子移向FeCl2溶液 | D. | 电流由石墨电极流向Fe电极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶质的电离方程式为NaHCO3=Na++H++CO32- | |
| B. | 25℃时,加水稀释后,n(H+)与n( OH-)的乘积变大 | |
| C. | 离子浓度关系:c( Na+)+c(H+)=c( OH-)+c( HCO3- )+c( CO32-) | |
| D. | 温度升高,c(HCO3-)增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若误饮c(Ba2+)=1.0×10-5mol/L溶液时,不会引起Ba2+中毒 | |
| B. | 因为Ksp(BaCO3)>Ksp(BaSO4),所以BaCO3不能作内服造影剂 | |
| C. | 向同浓度Na2SO4和Na2CO3的混合溶液中滴加BaCl2溶液,BaSO4先析出 | |
| D. | 在BaSO4和BaCO3共存的悬浊液中,c(SO42-):c(CO32-)=1:51 |
查看答案和解析>>
科目: 来源: 题型:解答题
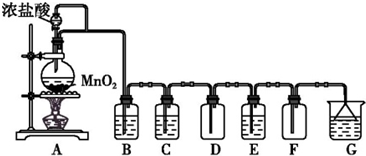
查看答案和解析>>
科目: 来源: 题型:解答题
| X | Y | |
| Z | W |
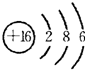 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①③⑤ | D. | ②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com