
科目: 来源: 题型:选择题
| A. | H+、Na+、NO3-、MnO4- | B. | OH-、Ba2+、Cl-、SO42- | ||
| C. | HCO3-、K+、OH-、NO3- | D. | NO3-、SO42-、K+、Mg2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在常温常压下,11.2 L氧气所含的分子数为0.5NA | |
| B. | 在常温常压下,1molHe的体积为22.4 L | |
| C. | 32 g氧气所含的原子数目为2NA | |
| D. | 在同温同压下,相同体积的任何气体所含的原子数相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a=1,b=2 | B. | a=2,b=1 | C. | a=2,b=2 | D. | a=3,b=2 |
查看答案和解析>>
科目: 来源: 题型:解答题
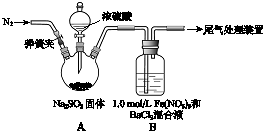
查看答案和解析>>
科目: 来源: 题型:解答题
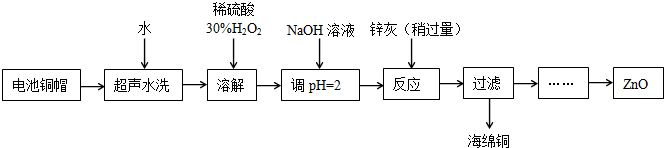
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目: 来源: 题型:解答题
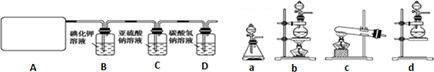
查看答案和解析>>
科目: 来源: 题型:解答题
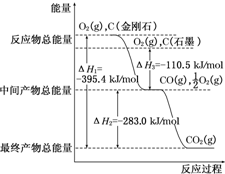 (1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式
(1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式查看答案和解析>>
科目: 来源: 题型:选择题
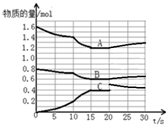 在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )
在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )| A. | 反应在前10s 内v(B)=0.005mol/(L.s) | |
| B. | 方程式计量数a:b:c为2:1:2 | |
| C. | 10 s时改变条件可能是升高温度,20s时平衡逆向进行 | |
| D. | 15~20s间,反应的平衡常数是2.7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定温度下,反应 MgCl2(l)═Mg(l)+Cl2(g)的△H>0、△S>0 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 在H2S溶液中,C(H+)和C(S2-)的比值为2:1 | |
| D. | 1 mol/L和0.1 mol/L的两瓶氨水中c(OH-)之比为10:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡前,充入氮气,容器内压强增大,反应速率加快 | |
| B. | 平衡时,其他条件不变,分离出硫,逆反应速率减小 | |
| C. | 平衡时,其他条件不变,升高温度可提高 SO2 的转化率 | |
| D. | 其他条件不变,缩小容器体积,平衡正反应方向移动,该反应的平衡常数不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com