
科目: 来源: 题型:解答题
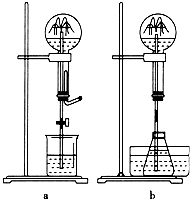 喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.
喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
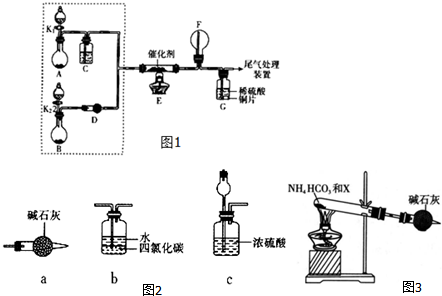
查看答案和解析>>
科目: 来源: 题型:选择题
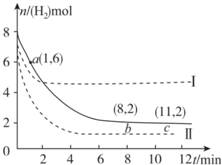 T℃时,6 mol CO2和 8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,6 mol CO2和 8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | 反应开始至a点时v(H2)=1 mol•L-1•min-1 | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应△H>0 | |
| C. | 曲线Ⅱ对应的条件改变是减少压强 | |
| D. | T℃时,该反应的化学平衡常数为0.125 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 开始加入合金的质量可能为3.0 g | |
| B. | 参加反应的硝酸的物质的量是0.1 mol | |
| C. | 完全生成沉淀时消耗NaOH溶液的体积为100 mL | |
| D. | 溶解合金时收集到NO气体的体积为2.24 L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10.5% | B. | 9.1% | C. | 8% | D. | 5% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | 将金属Na加入冷水中:2 Na+2 H2O═2 Na++2 OH-+H2↑ | |
| C. | 盐酸滴入澄清石灰水:Ca(OH)2+2 H+═Ca2++2 H2O | |
| D. | 澄清石灰水吸收氯气:Cl2+OH-═Cl-+ClO-+H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10 mL 0.1 mol•L-1的AlCl3溶液 | B. | 20 mL 0.1 mol•L-1的CaCl2溶液 | ||
| C. | 30 mL 0.2 mol•L-1的KCl溶液 | D. | 100 mL 0.25 mol•L-1的NaCl溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题

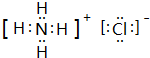 ,I的化学式Mg(OH)2;
,I的化学式Mg(OH)2;查看答案和解析>>
科目: 来源: 题型:解答题
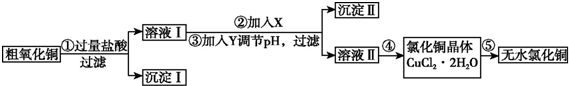
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的试剂:a.NaOH b.H2O2 c.Na2CO3 d.CuO | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com