
科目: 来源: 题型:选择题
| A. | ①、② | B. | ①、④ | C. | ①、③ | D. | ②、④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2(HCl):通过水洗涤 | B. | NO(NH3):通过水洗涤 | ||
| C. | NH4Cl(NaCl):加热混合物 | D. | NH4Cl溶液(I2):用CCl4萃取 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(PO43-):Na3PO4>Na2HPO4>NaH2PO4>H3PO4 | |
| B. | c(CO32-):(NH4)2CO3>Na2CO3>NaHCO3>NH4HCO3 | |
| C. | c(NH4+):(NH4)2SO4>(NH4)2CO3>NH4HSO4>NH4Cl | |
| D. | c(S2-):Na2S>NaHS>H2S |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、Al3+、OH-、Br- | B. | H+、Fe2+、SO42-、CO32- | ||
| C. | K+、NH4+、CO32-、OH- | D. | Ca2+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Q2=$\frac{{Q}_{1}}{2}$ | B. | Q2>$\frac{{Q}_{1}}{2}$ | C. | Q2<Q1<Q | D. | Q=Q1>Q2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 生石灰氧化钙可用作食品的防氧化剂 | |
| B. | P2O5不可用作食品干燥剂 | |
| C. | 无水硅胶可用作食品干燥剂 | |
| D. | 加工后具有吸水性的植物纤维可用作食品干燥剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
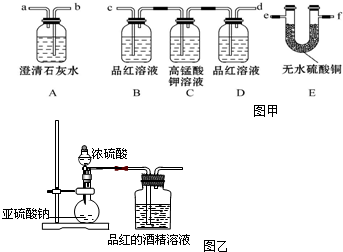
查看答案和解析>>
科目: 来源: 题型:填空题
 物质结构决定物质性质.回答下列问题:
物质结构决定物质性质.回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
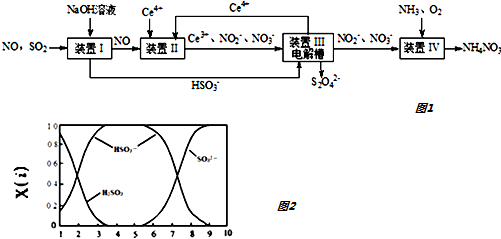
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com