
科目: 来源: 题型:选择题
| A. | 目前我国流通的硬币是由合金材料制造的 | |
| B. | 生铁、普通钢和不锈钢中的碳含量依次增加 | |
| C. | 装修门窗使用的铝合金材料的硬度比铝大,熔点比铝低 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:3 | B. | 1:2 | C. | 2:1 | D. | 3:2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 闪电时,N2变为NO | B. | NO被空气中O2氧化为NO2 | ||
| C. | 工业上,用N2合成氨 | D. | 豆科植物根瘤菌把N2变成NH3 |
查看答案和解析>>
科目: 来源: 题型:解答题
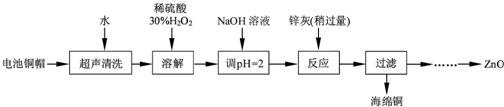
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目: 来源: 题型:解答题
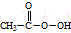 (过氧乙酸)+H2O
(过氧乙酸)+H2O查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定是碱溶液 | B. | 一定是酸溶液 | ||
| C. | 由水电离出的[OH-]=1×10-9mol•L-1 | D. | pH值可能为9也可能为5 |
查看答案和解析>>
科目: 来源: 题型:填空题
 四种短周期主族元素A、B、C、D均属于非金属元素,它们在周期表中的位置如图所示.请回答列问题:
四种短周期主族元素A、B、C、D均属于非金属元素,它们在周期表中的位置如图所示.请回答列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com