
科目: 来源: 题型:选择题
| A. | 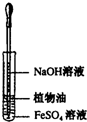 观察Fe(OH)2的生成 | B. | 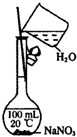 配制一定量浓度的NaNO3的溶液 | ||
| C. | 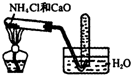 实验室制取氨气 | D. | 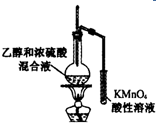 验证乙烯的生成 |
查看答案和解析>>
科目: 来源: 题型:选择题
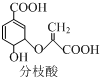 ,下列关于分枝酸的说法不正确的是( )
,下列关于分枝酸的说法不正确的是( )| A. | 分子中含有3种含氧官能团 | |
| B. | 1 mol分枝酸最多可与3mol NaOH发生中和反应 | |
| C. | 在一定条件下可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,但褪色原理不同 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(OH-)-n(H+)=(a-0.05)mol | |
| C. | 随着NaOH的加入,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$不断增大 | |
| D. | 当n(NaOH)=0.1mol时,c(OH-)>c(Cl-)-c(NH3•H2O) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则氢气的燃烧热为-241.8 kJ•mol-1 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量 | |
| C. | 己知2C(s)+2O2(g)═2CO2(g)△H=a;2C(s)+O2(g)=2CO(g);△H=b,则a>b | |
| D. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
查看答案和解析>>
科目: 来源: 题型:多选题
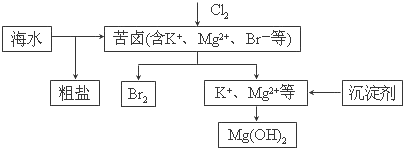
| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂和重结晶等过程提纯 | |
| C. | 工业生产中常选用NaOH作为沉淀剂 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其氧化吸收 |
查看答案和解析>>
科目: 来源: 题型:解答题
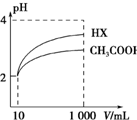 弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:
弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:| 弱酸化学式 | HNO2 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 5.1×10-4 | 1.8×10-5 | 6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
查看答案和解析>>
科目: 来源: 题型:解答题
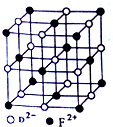 已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题:
已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含NA个N2和O2的混合气体中质子数不可能是15NA | |
| B. | 1 L 1 mol•L-1的CH3COONa溶液中CH3COOH和CH3COO-的总数为NA | |
| C. | 58g 分子式为C4H10的有机物中,所含有的甲基数一定为2NA | |
| D. | NA个CH4和NA个Cl2光照下充分反应,被取代的氢原子数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
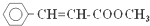 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.有关肉桂酸甲酯的叙述中,不正确的是( )
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.有关肉桂酸甲酯的叙述中,不正确的是( )| A. | 能与溴的四氯化碳溶液发生加成反应 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 在碱性条件下能发生水解反应 | |
| D. | 不可能发生加聚反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com