
科目: 来源: 题型:解答题
 请根据所学化学反应原理,解决以下问题:
请根据所学化学反应原理,解决以下问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液的浓度变为0.08mol/L | B. | 阳极上产生112ml O2 (标准状况) | ||
| C. | 转移的电子数是1.204×1022 个 | D. | 反应中有0.01mol Ag 被氧化 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 若向溶液F中加入K4[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液F中含有Fe2+ | |
| B. | 溶液N为深蓝色,说明溶液N中含大量Cu2+ | |
| C. | 合金样品中Cu的质量分数为$\frac{a-b-c}{a}$×100% | |
| D. | 合金样品中Al的质量分数为$\frac{9c}{17a}$×100% |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 丙烷和丙烯 | B. | 乙烯和环丙烷 | C. | 乙炔和丁炔 | D. | 甲烷和乙烷 |
查看答案和解析>>
科目: 来源: 题型:选择题
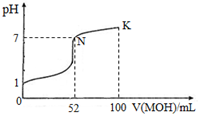 常温下,向100mL 0.l mol.L-lHCl的溶液p 中逐滴加入0.2mol.L-lMOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.l mol.L-lHCl的溶液p 中逐滴加入0.2mol.L-lMOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )| A. | MOH为一元强碱 | |
| B. | N点水的电离程度小于K点水的电离程度 | |
| C. | 在K点,c(M+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | K点对应的溶液中,有c( MOH)+c( M+)=0.2 mol.L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com