
科目: 来源: 题型:选择题
| 选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
| A | NaClO | 离子键、共价键 | 强氧化性 | 消毒液 |
| B | H2O2 |  | 不稳定,易分解 | 医用消毒剂 |
| C | NH3 | 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
| D | NaHCO3 | 离子键 | 受热易分解 | 泡沫灭火器 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题

 (R,R′为烃基或氢)
(R,R′为烃基或氢) (R,R′为烃基)
(R,R′为烃基)
 .
. .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
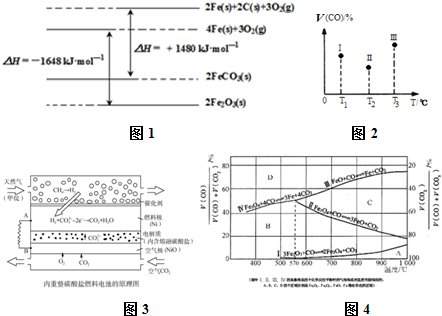
查看答案和解析>>
科目: 来源: 题型:解答题
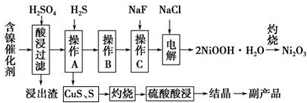 为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:
为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 测定时可用氯水代替过氧化氢氧化甲醛 | |
| B. | 足量H2O2氧化1molHCHO时放出的热量一定是①的2倍 | |
| C. | 上述方法测定甲醛含量时,如果H2O2过量,会导致甲醛含量的测定结果偏高 | |
| D. | H2O2氧化等物质的量甲醛(反应①)和甲酸时转移电子的数目相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定条件下,1molN2和3molH2充分反应,生成物中的N-H键数目为6NA | |
| B. | 9.2g 由NO2和N2O4组成的混合物中含有氧原子的数目为 0.2NA | |
| C. | 完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA | |
| D. | 1L 0.1 mol•L-l的Na2S溶液中S2-和HS-的总数为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氨水 | B. | 硝酸 | C. | 醋 | D. | 卤水 |
查看答案和解析>>
科目: 来源: 题型:解答题
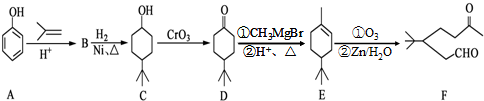
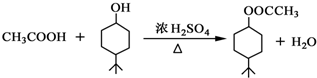 .
.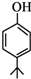 .同时满足下列条件的B的同分异构体(不包括B)共有11种:
.同时满足下列条件的B的同分异构体(不包括B)共有11种: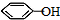 )和烃W为主要原料制备有机物3-乙基-1,6-已二酸的合成路线
)和烃W为主要原料制备有机物3-乙基-1,6-已二酸的合成路线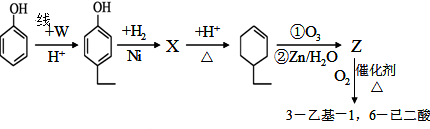
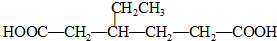
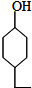 ,Z:
,Z: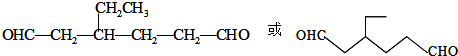 ;
;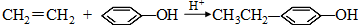 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:
自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com