
科目: 来源: 题型:选择题
 在常温下,用0.1000mol/L的盐酸滴定25mL 0.1000mol/L Na2CO3溶液,所得滴定曲线如图所示.下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )
在常温下,用0.1000mol/L的盐酸滴定25mL 0.1000mol/L Na2CO3溶液,所得滴定曲线如图所示.下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )| A. | a点:c( HCO3-)>c(Cl-)>c(CO32-) | |
| B. | b点:c(Na+)+c(H+)=c(Cl一)+c(HCO3-)+c(CO32-)+c(OH -) | |
| C. | c点:c(OH -)+c(CO32-)=c(H+)+c(H2CO3) | |
| D. | d点:c(Cl-)=c(Na+) |
查看答案和解析>>
科目: 来源: 题型:选择题
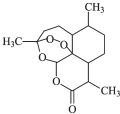 中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )| A. | 青蒿素分子式为C15H22O5 | |
| B. | 青蒿素含有“-O-O-”键具有较强的氧化性 | |
| C. | 青蒿素易发生加成反应和氧化反应 | |
| D. | 青蒿素在碱性条件下易发生水解反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 微粒组 | 加人试剂 | 发生反应的离子方程式 |
| A | Fe3+、I-、Cr- | NaOH溶液 | Fe3++30H-═Fe(0H)3↓ |
| B | K+、NH3•H20、CO32- | 通人少量CO2 | 20H-+C02═CO32-+H20 |
| C | H+,Fe2+、SO42- | Ba(NO3)2溶液 | SO42-+Ba2+═BaSO4↓ |
| D | Na+、Al3+、Cl- | 少量澄淸石灰水 | Al3++30H-═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 反应一段时间后,乙装置中生成的氢氧化钠在铁极区 | |
| B. | 乙装置中铁电极为阴极,电极反应式为Fe-2e -=Fe2+ | |
| C. | 通入氧气的一极为正极,发生的电极反应为O2-4e -+2H2O═4OH- | |
| D. | 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
 用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( ) | 气体 | a | b | C | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | CO2 | 稀硫酸 | 石灰石 | 饱和NaHCO3溶液 |
| C | 02 | 双氧水 | 二氧化锰 | 浓硫酸 |
| D | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25℃时,1 L pH=12的Ba( OH)2溶液中含有的OH-的数目为0.02 NA | |
| B. | 常温常压下,19 g H30+含有10 NA个电子 | |
| C. | l mol Fe与1 molCl2充分反应转移电子数为3NA | |
| D. | 标准状况下,11.2 L乙醇所含的羟基数为0.5 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 绿色化学的核心是从源头上防止和消除化工生产对环境的污染 | |
| B. | 减少化石燃料的使用,有利于降低空气中pM2.5的数值 | |
| C. | “地沟油”禁止食用,但可以用来制柴油、肥皂等 | |
| D. | 淀粉、豆油、蛋白质都是天然高分子化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
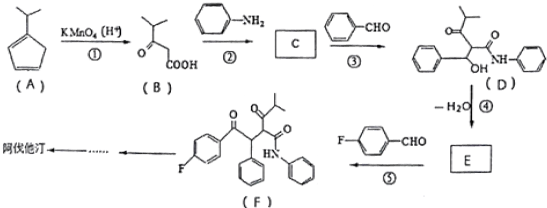
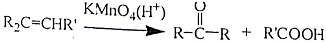 R、R′代表烃基)
R、R′代表烃基)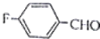 的名称对氟苯甲醛.
的名称对氟苯甲醛.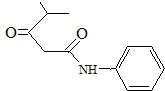 .
.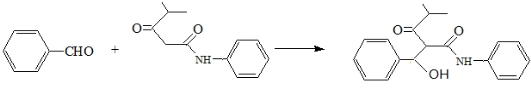 .
.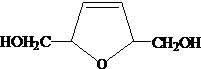 .
.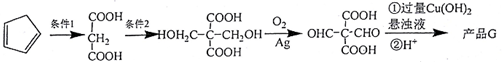
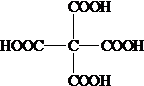 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 18 g H216O和20gH218O含有的质子数均为10 NA | |
| B. | l Ll mol/L的KAl(SO4)2溶液中阳离子总数为2 NA | |
| C. | 0.2 mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3 NA | |
| D. | 反应N2+3H2?2NH3达平衡时,每消耗3 molH2同时有2 NA个N-H断裂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com