
科目: 来源: 题型:选择题
| A. | 淀粉和纤维素都可用(C6H10O5)n表示,二者互为同分异构体 | |
| B. | Mg5(Si4O10)2(OH)2•4H2O的氧化物形式:5MgO•8SiO2•5H2O | |
| C. | Fe-2e-=Fe2+可表示钢铁析氢腐蚀和吸氧腐蚀的正极反应 | |
| D. | 乙醇分子的比例模型: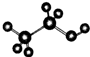 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | m+n<p | B. | 平衡向逆反应方向移动 | ||
| C. | C的体积分数增大 | D. | A的转化率降低 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
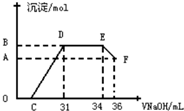 研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.往反应结束后的溶液中,逐滴加入2mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列选项正确的是( )
研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.往反应结束后的溶液中,逐滴加入2mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列选项正确的是( )| A. | 图中OC段的离子方程式为:NH4++OH-═NH3•H2O | |
| B. | 在DE段的离子方程式为:H++OH-═H2O | |
| C. | B与A的差值为 0.002mol | |
| D. | C点对应的氢氧化钠溶液的体积为7 mL |
查看答案和解析>>
科目: 来源: 题型:选择题
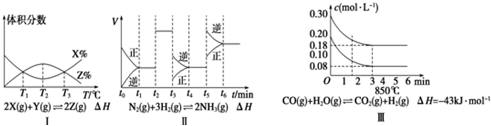
| A. | 由图I知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 由图II知,反应在t1时,NH3体积分数最大 | |
| C. | 由图II知,t3时采取的措施是降低反应体系温度 | |
| D. | III在10 L容器、850℃时反应,由图知,到4 min时,反应放出5.16 kJ的热量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可逆反应的特征是正反应速率和逆反应速率相等 | |
| B. | 在其他条件不变时,增大压强一定会破坏气体反应的平衡状态 | |
| C. | 在其他条件不变时,升高温度可以使平衡向放热反应方向移动 | |
| D. | 在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④⑦ | B. | ②⑤⑥ | C. | ①④ | D. | ②③⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:选择题
 已知NO2与N2O4相互转化:2NO2(g)?N2O4(g);△H=-24.2kJ/mol
已知NO2与N2O4相互转化:2NO2(g)?N2O4(g);△H=-24.2kJ/mol| A. | a,b,c,d四点中c正与v逆均相等 | |
| B. | 反应进行到10min时,体系吸收的热量为9.68kJ | |
| C. | 前10min内,用v(NO2)表示的该反应速率为0.02mol/L•min | |
| D. | 25min时,导致平衡移动的原因是升温 |
查看答案和解析>>
科目: 来源: 题型:解答题
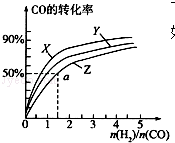 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com