
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 3:1 | B. | 4:1 | C. | 3:2 | D. | 7:2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 8g CH4所含共价键数目为2NA | |
| B. | 0.5NA 个氯气分子与水反应转移电子数为0.5NA | |
| C. | 50mL12mol/L盐酸与足量的MnO2共热,转移的电子数为0.3NA | |
| D. | 1 L0.2mol/L的Na2S溶液中离子数为0.6NA |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 样品中Fe元素的质量为2.24 g | B. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | ||
| C. | 样品中CuO的质量为4.0 g | D. | V=896 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 加入 试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
| 实验 现象 | 红色固体和 蓝色溶液 | 无色气体 | 无色气体和 蓝色溶液 | 红棕色气体 和蓝色溶液 |
| A. | Cu | B. | Cu2O | ||
| C. | 一定有Cu2O,可能有Cu | D. | 一定有Cu,可能有Cu2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ${\;}_y^m$X | B. | ${\;}_y^{y+m}$X | C. | ${\;}_{y+n}^{m+y-n}$X | D. | ${\;}_{y+n}^{m+y+n}$X |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 盐酸与Na2SiO3溶液混合:SiO32-+2H+═H2SiO3 | |
| B. | Cl2和H2O反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | NO2通入水中:H2O+3NO2═2H++2NO3-+NO | |
| D. | 浓盐酸和二氧化锰共热制Cl2:MnO2+4H++2Cl-═Mn2++Cl2+2H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
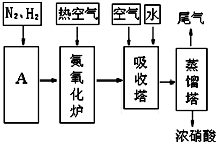
 CO+3H2.
CO+3H2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com