
科目: 来源: 题型:解答题
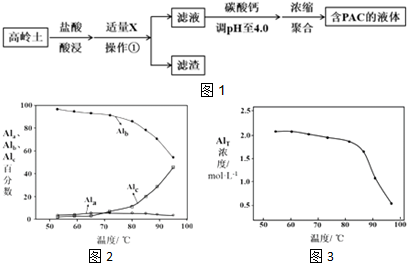
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 1.5 |
| 完全沉淀时 | 4.7 | 2.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
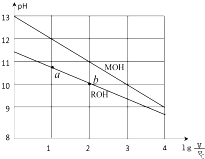 室温下,将浓度均为0.10mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述错误的是( )
室温下,将浓度均为0.10mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述错误的是( )| A. | ③⑤ | B. | ①⑤ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:解答题
 氨是一种重要的化工原料,氨的合成和应用仍是当前的重要研究内容之一.化学方程式为N2(g)+3H2(g)?2NH3(g)△H<0
氨是一种重要的化工原料,氨的合成和应用仍是当前的重要研究内容之一.化学方程式为N2(g)+3H2(g)?2NH3(g)△H<0查看答案和解析>>
科目: 来源: 题型:选择题
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | Ka=1.75×10-5 | Ka=4.2×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 等物质的量浓度的四种酸溶液中,pH最大的是亚硫酸 | |
| B. | 等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 | |
| C. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-═$CO_3^{2-}$+2HClO | |
| D. | 醋酸与NaHSO3溶液反应的离子方程式为:CH3COOH+HSO3-═SO2+H2O+CH3COO- |
查看答案和解析>>
科目: 来源: 题型:解答题
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2浓度mol•L-1 | 4.00 | 3.70 | 3.50 | 3.36 | 3.26 | 3.18 | 3.10 | 3.00 | 3.00 | 3.00 |
| CO浓度/mol•L-1 | 0.00 | 0.90 | 1.50 | 1.92 | 2.22 | 2.46 | 2.70 | - | - | - |
查看答案和解析>>
科目: 来源: 题型:解答题
 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类数相同 | |
| B. | 乙烷、苯、裂化汽油溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环已烷的密度都比水大 | |
| D. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 与水反应可生成酸的氧化物都是酸性氧化物 | |
| B. | 既能与酸反应又能与碱反应的物质一定是两性氧化物或两性氢氧化物 | |
| C. | 晶体的熔化、水的汽化和液化、KMnO4溶液的酸化以及煤的气化和液化均属物理变化 | |
| D. | 有单质参加的反应或有单质生成的反应不一定是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com