
科目: 来源: 题型:选择题
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值减小 | |
| B. | 浓度均为0.1 mol/L的Na2CO3、NaHCO3混合溶液中:c(CO32-)<c(HCO3-),且2c(Na+)═3c(H2CO3)+3c(HCO3-)+3c(CO32-) | |
| C. | pH=1与pH=2的CH3COOH)溶液中,c(H+)浓度之比为1:10 | |
| D. | 常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+) |
查看答案和解析>>
科目: 来源: 题型:解答题
 人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.| 金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
| 浓度(g•L-1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
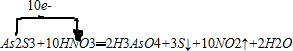 ;
;查看答案和解析>>
科目: 来源: 题型:解答题
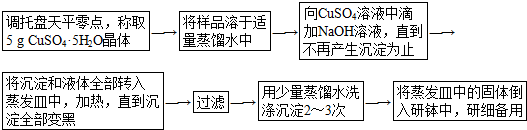
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe2+ 2mol/L、Cu2+ 0.5mol/L | B. | Fe2+ 1mol/L、Fe3+ 1mol/L | ||
| C. | Fe2+ 0.5mol/L、Cu2+ 0.25mol/L | D. | Fe2+ 1.5mol/L、Cu2+ 0.5mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,23g NO2和N2O4的混合物气体中总原子数为1.5NA | |
| B. | 3.4gNH3中含原子总数为0.6 NA | |
| C. | 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量约为28g | |
| D. | 标况下,33.6 L的水中,水分子数为1.5NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{a}{288V}$mol/L | B. | $\frac{125a}{36V}$mol/L | C. | $\frac{125a}{18V}$mol/L | D. | $\frac{125a}{54V}$mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com