
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
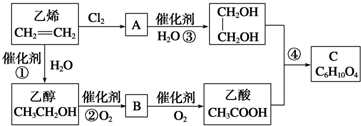
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | Li2NH中N的化合价是-1 | B. | 该反应中H2既是氧化剂又是还原剂 | ||
| C. | H-的离子半径比Li+大 | D. | 此法储氢和钢瓶储氢的原理相同 |
查看答案和解析>>
科目: 来源: 题型:解答题
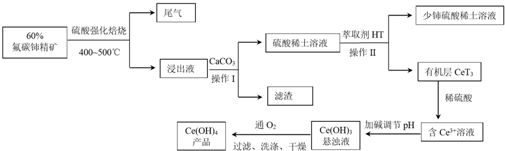
查看答案和解析>>
科目: 来源: 题型:多选题
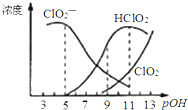 亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )
亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )| A. | HClO2的电离平衡常数的数值Ka=10-6 | |
| B. | 亚氯酸钠在碱性条件下较稳定 | |
| C. | pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c( ClO2)>c( Cl-) | |
| D. | 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2Na2O2+CO2═2Na2CO3+O2 | B. | 2Na2O2+2SO3═2Na2SO4+O2 | ||
| C. | Na2O2+H2SO4═Na2SO4+H2O2 | D. | 3Na2O2+Cr2O3═2Na2CrO4+Na2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该混盐具有较强的氧化性 | |
| B. | 该混盐中氯元素的化合价为+1和-1价 | |
| C. | 该混盐与盐酸反应产生1mol Cl2时转移1mol电子 | |
| D. | 该混盐的水溶液显酸性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 式量相同的物质是同种物质 | |
| B. | 分子式相同的不同有机物一定是同分异构体 | |
| C. | 具有同一通式的物质属于同系物 | |
| D. | 分子中含有碳与氢的化合物是烃类 |
查看答案和解析>>
科目: 来源: 题型:解答题
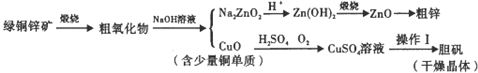

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com