
科目: 来源: 题型:解答题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3、SO42- |
查看答案和解析>>
科目: 来源: 题型:解答题
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备其单质 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
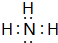 .
.查看答案和解析>>
科目: 来源: 题型:选择题
 图为北京奥运会的奖牌--“金镶玉”牌,使用了昂贵的玉石材料,其化学成分多为含水钙镁硅酸盐,如Ca2Mg5Si8O22(OH)2等.下列说法正确的是( )
图为北京奥运会的奖牌--“金镶玉”牌,使用了昂贵的玉石材料,其化学成分多为含水钙镁硅酸盐,如Ca2Mg5Si8O22(OH)2等.下列说法正确的是( )| A. | Ca2Mg5Si8O22(OH)2可用氧化物的形式表示为2CaO•5MgO•8SiO2•H2O | |
| B. | 从分类的角度看,Ca2Mg5Si8O22(OH)2为氧化物 | |
| C. | 玉石材料性质稳定,耐强酸和强碱的腐蚀 | |
| D. | Ca2Mg5Si8O22(OH)2易溶于水 |
查看答案和解析>>
科目: 来源: 题型:解答题
 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(H+)+c(HB-)+2c(H2B)=c(OH-) | B. | c(Na+)+c(OH-)=c(H+)+c(HB-) | ||
| C. | c(Na+)+c(H+)=c(OH-)+c(HB-)+c(B2-) | D. | 2c(B2-)+2c(HB-)=0.2mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 如果容器内压强不再改变,则证明该反应已达到平衡状态 | |
| B. | 寻找合适的催化剂是加快反应速率并提高CO2产率的有效措施 | |
| C. | 当反应达到平衡后,保持容器内体积不变,再向其中充入CO和H2O(g)各1 mol,达到新的平衡后CO2的产率会增大 | |
| D. | 如果在某温度下平衡常数为9.0,则平衡时CO转化率为75% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 氢氧化钙溶液与碳酸氢镁溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | KI溶液与H2SO4酸化的H2O2溶液混合:2 I-+H2O2+2 H+═2 H2O+I2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| B. | 除短周期外,其它周期均为18种元素 | |
| C. | 乙元素的族序数比甲元素的族序数小 | |
| D. | 甲、丙元素最高价氧化物对应水化物的酸性强弱:甲<丙 |
查看答案和解析>>
科目: 来源: 题型:解答题
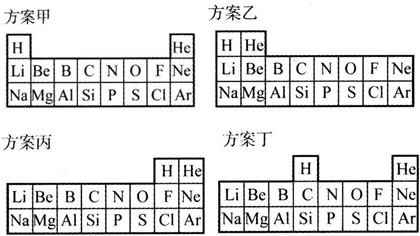
| “合理”的理由 | |
| 方案甲 | |
| 方案乙 | |
| 方案丙 | |
| 方案丁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com