
科目: 来源: 题型:选择题
| A. | SiO2是沙子的主要成分,纯净的SiO2是光纤制品的基本原料 | |
| B. | 水晶的基本结构单元是[SiO4]四面体结构 | |
| C. | 将游离态的氮转变为氮的化合物就是氮的固定,合成氨是一种人工固氮方法 | |
| D. | 将等物质的量的氯气和二氧化硫同时通入品红溶液中,褪色比二氧化硫通入品红溶液快 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 漂白粉溶液中加入少许食醋可以增强其漂白效果 | |
| B. | 用二氧化硫漂白米粉是违法行为,因为二氧化硫有毒 | |
| C. | 铝制品在生活中非常普遍,这是因为铝不活泼 | |
| D. | 氢氧化铝可用于治疗胃酸过多,但不宜长期服用 |
查看答案和解析>>
科目: 来源: 题型:解答题
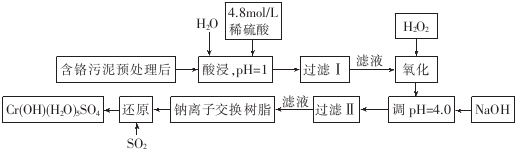
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0 溶解) |
查看答案和解析>>
科目: 来源: 题型:解答题
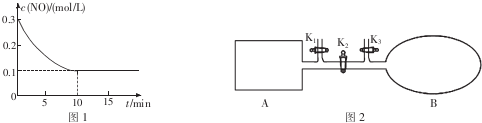
查看答案和解析>>
科目: 来源: 题型:解答题
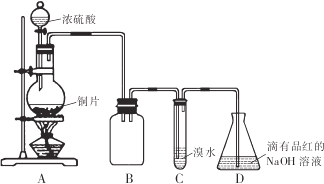
| 序号 | 实 验操作 | 现 象 | 结 论 |
| ① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
| ③ | 滴加少量溴水,振荡 | Ⅱ | |
| ④ | 滴加少量酸性KMn04溶液、振荡 | 溶液为紫色 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaCl溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | 澄清石灰水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaH+H2O═NaOH+H2↑ | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com