
科目: 来源: 题型:解答题
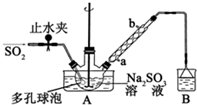 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:查看答案和解析>>
科目: 来源: 题型:选择题
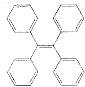 有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如图所示,下列说法正确的是( )
有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如图所示,下列说法正确的是( )| A. | 该有机物的分子式为C26H22 | |
| B. | 该有机物属于苯的同系物 | |
| C. | 该有机物的一氯代物有4种 | |
| D. | 该有机物既可发生氧化反应,又可发生还原反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
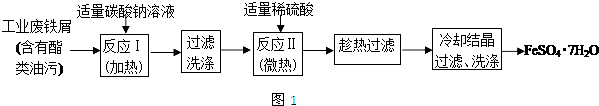

查看答案和解析>>
科目: 来源: 题型:填空题
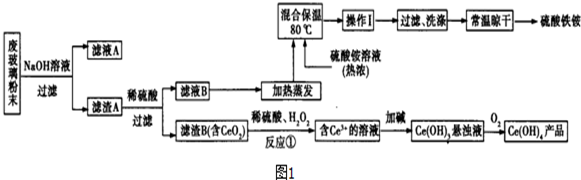
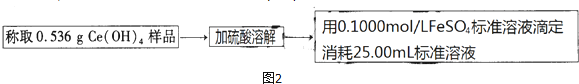
查看答案和解析>>
科目: 来源: 题型:填空题
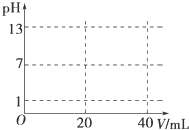 溶液中的化学反应大多是离子反应.根据要求回答下列问题.
溶液中的化学反应大多是离子反应.根据要求回答下列问题.查看答案和解析>>
科目: 来源: 题型:解答题
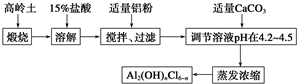
查看答案和解析>>
科目: 来源: 题型:解答题
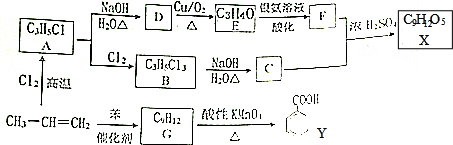
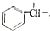 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$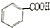
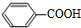 +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$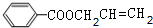 +H2O.
+H2O.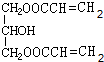 (任写一种即可).对于化合物X,下列说法正确的是AC.
(任写一种即可).对于化合物X,下列说法正确的是AC.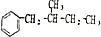 :则Z的同分异构体中,符合
:则Z的同分异构体中,符合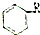 结构且有2个CH3的有3种(不包括Z).
结构且有2个CH3的有3种(不包括Z).查看答案和解析>>
科目: 来源: 题型:解答题
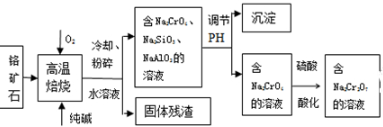
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目: 来源: 题型:解答题
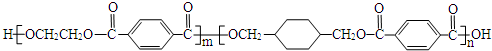
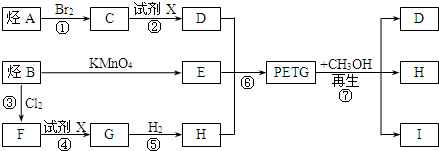
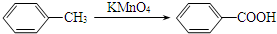
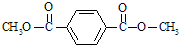 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com