
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
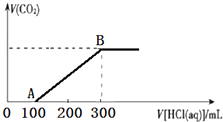 200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液.向上述所得溶液中,逐滴滴加2mol•L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液.向上述所得溶液中,逐滴滴加2mol•L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:查看答案和解析>>
科目: 来源: 题型:选择题
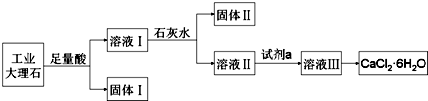
| A. | 固体Ⅰ中含有SiO2,固体Ⅱ中含有Fe(OH)3 | |
| B. | 使用石灰水时,要控制pH,防止固体Ⅱ中Al(OH)3转化为AlO2- | |
| C. | 试剂a选用盐酸,从溶液Ⅲ得到CaCl2•6H2O产品的过程中,须控制条件防止其分解 | |
| D. | 若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2•6H2O |
查看答案和解析>>
科目: 来源: 题型:多选题
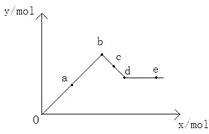
| A. | a-b时沉淀的物质的量:Al(OH)3比BaSO4多 | |
| B. | c-d时溶液中离子的物质的量:AlO2-比Ba2+多 | |
| C. | a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3 | |
| D. | d-e时溶液中离子的物质的量:Ba2+可能等于OH- |
查看答案和解析>>
科目: 来源: 题型:解答题
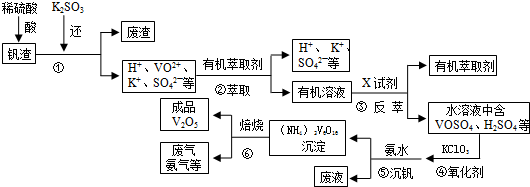
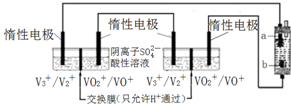
查看答案和解析>>
科目: 来源: 题型:解答题
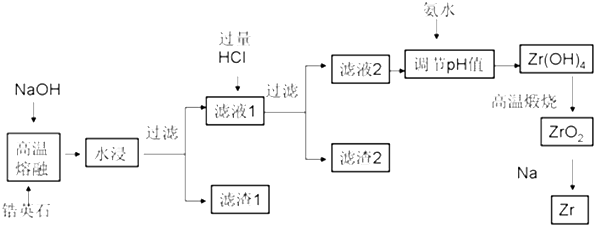
| 沉淀物 | Zr(OH)4 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时pH | 1.2 | 2.7 | 3.4 | 6.3 |
| 完全沉淀时pH | 2.4 | 3.2 | 5.2 | 9.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
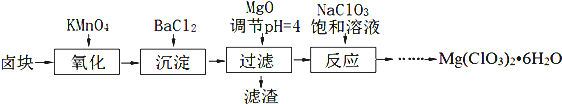
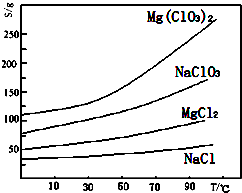
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡常数K=$\frac{8}{3}$ | |
| B. | 达到平衡后NO2和SO2的转化率相等 | |
| C. | SO3和NO的体积比保持不变可以证明达到平衡状态 | |
| D. | 每消耗1molSO3的同时生成1molNO2可以证明达到平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com