
科目: 来源: 题型:选择题
| A. | 将溶质物质的量之比为 2:7 的三氯化铝溶液和氢氧化钡溶液混合:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 向硫酸氢钠溶液中滴加 Ba(OH)2 至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 敞开体系,向FeCl2 溶液滴加NaOH 溶液:4Fe2++8OH-+O2+2H2O═4Fe(OH)3↓ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③④ | C. | ①②④ | D. | ①②④⑧ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol NaCl 分子 | |
| B. | 质子数为 35、中子数为 45 的溴原子:${\;}_{35}^{45}$ Br | |
| C. | 硫离子的结构示意图: | |
| D. | NH4+ 的电子式: |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 天津港爆炸残留的剧毒物 NaCN,利用双氧水将其氧化为 NaHCO3 和 NH3降低毒性 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5 微粒均具有丁达尔效应 | |
| C. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| D. | 氢氧化钠可作胃酸的中和剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
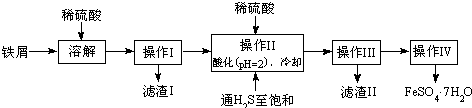
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
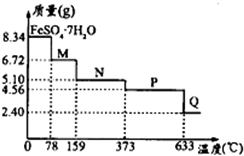
查看答案和解析>>
科目: 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 |
| A. | 向NaCN 溶液中通入少量CO2发生的离子反应为:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大 于a | |
| D. | NaHCO3和Na2CO3的混合溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 转移容易后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称氢氧化钠固体时直接放在称量纸上称 | |
| C. | 在容量瓶中进行定容时俯视刻度线 | |
| D. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度、溶解度、物质 | (NH4)2SO4 | FeSO4•7H2SO4 | 硫酸亚铁铵晶体 |
| 10 | 73.0 | 40.0 | 18.1 |
| 20 | 75.4 | 48.0 | 21.1 |
| 30 | 78.0 | 60.0 | 24.5 |
| 40 | 81.0 | 73.3 | 27.9 |
| 50 | 84.5 | - | 31.3 |
| 70 | 91.9 | - | 38.5 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com