
科目: 来源: 题型:选择题
| A. | 常温下,0.1mol/LNa2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-)>c(H+) | |
| C. | pH相同的①CH3 COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | ||
| Z | M | R |
| A. | 元素的非金属性次序为:Y>X>M | |
| B. | 气态氢化物稳定性:M>R | |
| C. | Z的氧化物可以做光导纤维 | |
| D. | 最高价氧化物对应水化物的酸性:Y>X |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | NaHCO3溶液中加入HCl:CO32-+2H+═CO2↑+H2O | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| D. | “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:$ClO_3^-$+5Cl-+6H+═3Cl2↑+3H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C18H34O2 | B. | C17H32O2 | C. | C18H36O2 | D. | C16H32O2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
查看答案和解析>>
科目: 来源: 题型:解答题
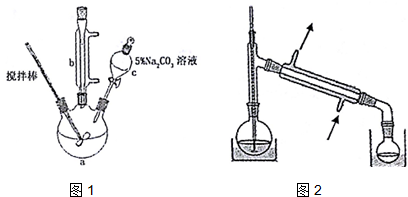
| 沸点 | 溶解性 | ||
| 丙烯酸 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
| 甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
| 丙烯酸甲酯 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
查看答案和解析>>
科目: 来源: 题型:解答题
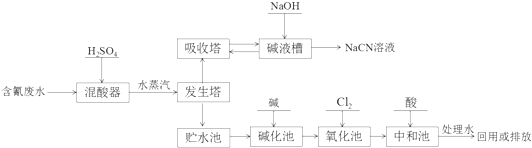
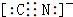 .
.查看答案和解析>>
科目: 来源: 题型:解答题
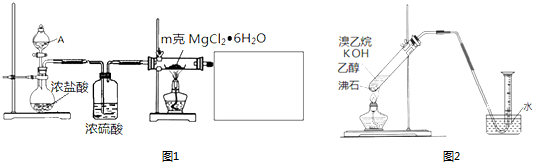
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=4.3的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 浓度为0.2 mol/L的CH3COOH溶液和浓度为0.1mol/L的NaOH溶液等体积混合后:c(CH3COO -)-c(CH3COOH)=2[c(H+)-c(OH-)] | |
| C. | 醋酸浓溶液加少量水稀释,$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$几乎不变 | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe( NO3)3溶液中加入过量HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 浓烧碱溶液中加入铝片:2A1+2OH-═2AlO2-+H2 | |
| C. | H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4+H2O | |
| D. | 将新制氢氧化铜悬浊液加入氨水中:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com