
科目: 来源: 题型:选择题
| A. | 可加入烧碱溶液以提高电池的性能,碱性电池的能量和可储存时间均较高 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 充电过程中,电池正极材料的质量减少 | |
| D. | 放电时电池正极反应为:FePO4+Li+-e-═LiFePO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 | 36.1 |
| *燃烧热(kJ•mol-1) | 1560.7 | 2219.2 | 2877.6 | 3535.6 |
| A. | 正庚烷在常温常压下肯定不是气体 | |
| B. | 直链烷烃燃烧热和其所含碳原子数呈线性关系 | |
| C. | 随碳原子数增加,直链烷烃沸点逐渐升高 | |
| D. | 随碳原子数增加,直链烷烃沸点和燃烧热都成比例增加 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 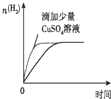 等质量锌粉与足量盐酸反应 | |
| B. | 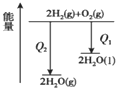 氢气与氧气反应中的能量变化 | |
| C. | 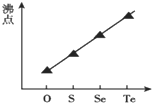 气态氢化物沸点 | |
| D. | 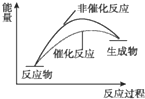 催化反应与非催化反应过程中的能量关系 |
查看答案和解析>>
科目: 来源: 题型:解答题
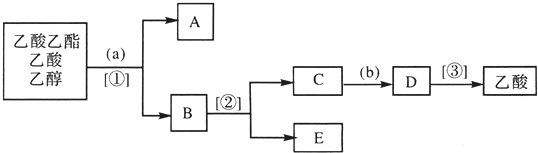
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 将Al投入到烧碱溶液中:2Al+2OH-═AlO2-+2H2O | |
| C. | 将Al(OH)3投入到烧碱溶液中:Al(OH)3+OH-═AlO2-+2H2O | |
| D. | 向NaHCO3溶液中加入适量KOH溶液:HCO3-+OH-═CO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 阳极100g,阴极128g | B. | 阳极96.8g,阴极110.8g | ||
| C. | 阳极94.8g,阴极108.8g | D. | 阳极95.9g,阴极114.0g |
查看答案和解析>>
科目: 来源: 题型:选择题
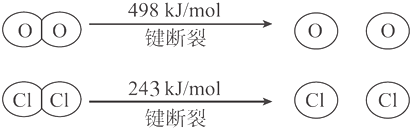
| A. | 12kJ | B. | 32kJ | C. | 115.6kJ | D. | 127.6kJ |
查看答案和解析>>
科目: 来源: 题型:解答题
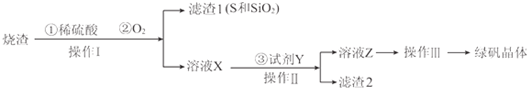
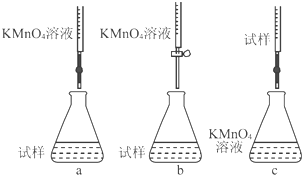
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com