
科目: 来源: 题型:解答题
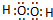 ,W第一步电离方程式为H2O2?H++HO2-.
,W第一步电离方程式为H2O2?H++HO2-.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 聚丙烯塑料的结构简式为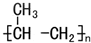 | |
| B. | 聚氯乙烯塑料单体的电子式为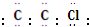 | |
| C. | 塑料购物袋的生产原料需要消耗大量木材 | |
| D. | 聚乙烯中含碳质量分数与其单体的含碳质量分数相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电子由锌经外电路流向氧化银 | |
| B. | 该电池可实现化学能和电能的相互转化 | |
| C. | 锌是负极,氧化银是正极 | |
| D. | 工作时,负极区溶液pH减小,正极区pH增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
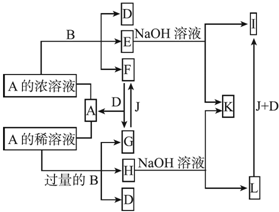
查看答案和解析>>
科目: 来源: 题型:解答题
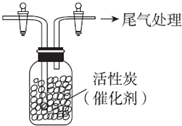 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查看答案和解析>>
科目: 来源: 题型:解答题
 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号表示):
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号表示):查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 稀硝酸和碳酸钠 | B. | 氧化铜和稀硝酸 | C. | 碳和浓硫酸 | D. | 铜和浓硝酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al、Cu、Mg、Si | B. | Al、Mg、Si、Zn | C. | Al、Fe、C、Cu | D. | Al、Si、Zn、Na |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 高级脂肪酸甘油酯是高分子化合物 | |
| B. | 天然的不饱和高级脂肪酸甘油酯都是混甘油酯 | |
| C. | 植物油可以使酸性高锰酸钾溶液褪色 | |
| D. | 油脂皂化完全后原有的液体分层现象消失 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向NaAlO2溶液通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+2I-+8H+═3Fe2++I2+4H2O | |
| C. | 用FeS除去工业废水中的Hg2+:Hg2++S2-═HgS↓ | |
| D. | 向饱和的Ca(OH)2溶液中滴加过量NaHCO3溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com